“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol相关数据如下
CH3OH(g)+H2O(g) △H=-49.0kJ/mol相关数据如下
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2(g)和3molH2(g) |
1molCH3OH和1molH2O(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出29.4kJ |
吸收akJ |
请回答:①c1_________c2(填“>”“<”或“=”),a=_________;
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是______mol/(L·s)-1;
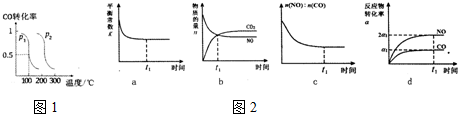
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g) CH3OH(g),平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
CH3OH(g),平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于_____(填“吸”或“放”)热反应,p1_____p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=_____(用含b的代数式表示)。
(3)治理汽车尾气的反应是2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0 ;在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是_____。
2CO2(g)+N2(g) △H<0 ;在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是_____。
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C 、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)。
、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)。
(2)A、B、C形成的化合物的晶体类型为,电子式为。
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式。
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式。
(5)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的热化学方程式。
(6)含有元素C的盐的焰色反应为________色.许多金属盐都可以发生焰色反应,其原因是_______________________ ________________________________.
________________________________.
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有种。
(2)请写出Cr元素的核外电子排布式。
(3)某元素的正三价离子的3d能级为半充满,该元素的元素名称为,其单质在一定条件下能与S反应,试写出该反应的化学方程式。
(4)某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的电子排布图为。
(11分) (1)有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这三种晶体进行实验,结果见下表。
| 项目 |
熔点/℃ |
硬度 |
水溶性 |
导电性 |
水溶液与Ag+反应 |
| A |
811 |
较大 |
易溶 |
水溶液(或熔融)导电 |
白色沉淀 |
| B |
3 500 |
很大 |
不溶 |
不导电 |
不反应 |
| C |
-114.2 |
很小 |
易溶 |
液态不导电 |
白色沉淀 |
① 晶体的化学式及晶体类型分别为:
A____________;B__________;C____ ____。
② 晶体中粒子间的作用分别为:
A_________;B________;C________。
(2)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
①写出与H2O分子互为等电子体的微粒__________(填一种即可)。
②水分子在特定条件下容易得到一个H+,形成水合氢离 子(H3O+)。下列对上述过程的描述不合理的是()
子(H3O+)。下列对上述过程的描述不合理的是()
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
③下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)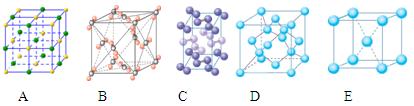
在下列物质中:①K2SO4②H2O2 ③(NH4)2S ④Na2O2 ⑤C2H2 ⑥SiC
⑦Na2S⑧单晶硅⑨Cu。(填序号)其中含有极性共价键的原子晶体是;其中既含有离子键又含有共价键的离子晶体是;其中含有极性共价键和非极性共价键的非极性分子是;直接由原子构成的晶体是;受热融化后化学键不发生变化的是。
(12分) 短周期的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素最外电子层上的电子数的和;Y元素原子最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请完成下列问题:
(1)X元素的名称是___ __;Y元素的名称是______;Z元素的名称是___ ____;
(2)XZ3化合物的化学式是______ _______,Y元素所形成的最高价氧化物的电子式是___ ____;
(3) X、Y的最高价氧化物的水化物的酸性强弱:__________(用化学式表示);
⑷将铜片投放到X的最高价氧化物的水化物的稀溶液中,观察到铜片上有气泡产生,写出该反应的离子方程式:。