[化学选修2——化学与技术]
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组,将一批废弃的线路析简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
(1)第①步Cu与酸反应的所有的离子方程式为_______;得到滤渣1的主要成分为___________。
(2)第②步加H2O2的作用是___________,使用H2O2的优点是___________,调溶液pH的目的是使________________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(S04)3•18H2O,探究小组设计了三种方案:
上述三种方案中,________方案不可行,原因是________________从原子利用率角度考虑,__________方案更合理。
以甲醇为替代燃料是解决我国石油资源短缺的重要措施。
(1)CO、CO2可用于甲醇的合成,其相关反应的热化学方程式如下:
CO(g)+2H2(g)=CH3OH(g)△H=" -102.5" kJ·mol-1
CO(g)+H2O(g) = CO2(g)+H2(g)△H ="-42.9" kJ·mol-1
则反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H = kJ·mol-1
反应CO(g)+H2O(g) = CO2(g)+H2(g)的平衡常数K的表达式为 。
(2)用CO2合成甲醇时可选用亚铬酸锌(ZnCr2O4)或CuCl为催化剂。
①工业制备亚铬酸锌是用CO还原ZnCrO4·H2O,同时生成ZnO。该反应的化学方程式是 。以亚铬酸锌为催化剂时,工业上的适宜温度是:350℃~420℃,可能的原因是 。
② CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu=2CuC1。在实验过程中应先加入浓盐酸,发生反应CuCl + HCl H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7。
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7。
(3)直接甲醇燃料电池结构如图所示,则负极反应是 。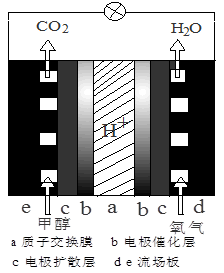
工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO + 2Cl- + 4H+ = 2ClO2↑+ Cl2↑+ 2H2O。
+ 2Cl- + 4H+ = 2ClO2↑+ Cl2↑+ 2H2O。
(1)写出第二步反应的离子方程式 。
(2)工业生产时需在反应物中加少量Cl-,其作用是 。
(3)生产中会发生副反应ClO + Cl- + H+ - Cl2↑+ H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为 。
+ Cl- + H+ - Cl2↑+ H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为 。
化学物I是治疗失眠症药物雷美替胺的中间体,其合成路线如下: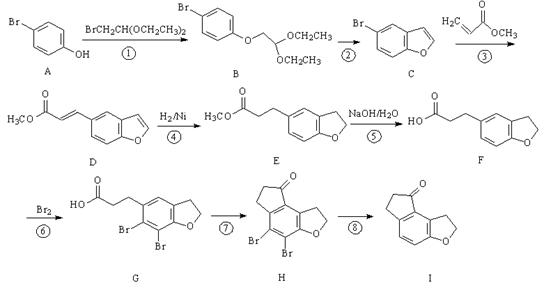
(1)反应①的类型为: ,反应④的类型为: 。
(2)物质F中含氧官能团的名称为 。
(3)反应③会生成与D互为同分异构体的副产物,该反应的方程式为 。
(4)若未设计反应⑥,则化合物I中可能混有杂质,该杂质同样含有一个六元环和两个五元环,其结构简式为 。
(5)写出同时满足下列条件的物质I的一种同分异构体的结构简式 。
①能发生银镜反应;②能发生水解反应;③分子的核磁共振氢谱有5个峰。
(6)已知: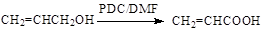
以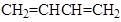 、
、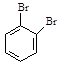 为原料,合成
为原料,合成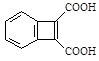 ,写出合成流程图(无机试剂任用)。合成流程图示例如下:
,写出合成流程图(无机试剂任用)。合成流程图示例如下:
由菱镁矿(主要成分为MgCO3)制阻燃型氢氧化镁的工艺流程如下: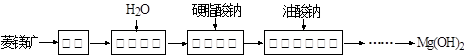
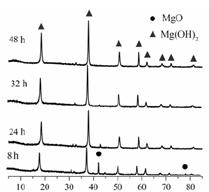



(1)从图可以得出的结论为、。
(2)水化反应MgO+H2O = Mg(OH)2能自发进行的原因是。
(3)结合元素周期律和表1可知,金属氢氧化物受热分解的规律有。(写一条即可)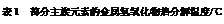
LiOH |
NaOH |
KOH |
Al(OH)3 |
Mg(OH)2 |
Ca(OH)2 |
Ba(OH)2 |
| 924 |
不分解 |
不分解 |
140 |
258 |
390 |
700 |
(4)已知热化学方程式:Mg(OH)2 (s) =" MgO" (s)+H2O (g) ΔH =" 81.5" kJ·mol-1
①Mg(OH)2起阻燃作用的主要原因是。
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是。
(1)已知短周期元素X的电离能数据如下(kJ·mol-1):
| 电离能 |
I1 |
I2 |
I3 |
I4 |
| X |
577 |
1817 |
2745 |
11578 |
由X的电离能数据判断,X通常显价。
(2)单质硼有无定形和晶体两种,参考下表数据回答: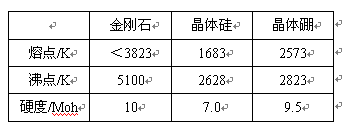
①晶体硼的晶体类型属于__________晶体,理由是_____________________________。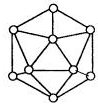
②已知晶体硼的结构单元是由硼原子组成的正二十面体(如下图),其中有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由__________个硼原子构成的,其中B—B键的键角为____________。