(1)已知短周期元素X的电离能数据如下(kJ·mol-1):
| 电离能 |
I1 |
I2 |
I3 |
I4 |
| X |
577 |
1817 |
2745 |
11578 |
由X的电离能数据判断,X通常显 价。
(2)单质硼有无定形和晶体两种,参考下表数据回答: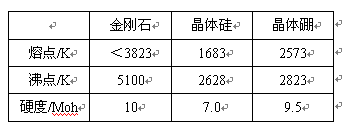
①晶体硼的晶体类型属于__________晶体,理由是_____________________________。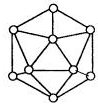
②已知晶体硼的结构单元是由硼原子组成的正二十面体(如下图),其中有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由__________个硼原子构成的,其中B—B键的键角为____________。
(1)粗盐中常含有可溶性杂质CaCl2、MgCl2和Na2SO4。现用下列试剂:①NaOH溶液② BaCl2溶液③Na2CO3溶液,分别除去以上三种杂质。其中MgCl2是选择试剂____(填序号)除去的,有关反应的离子方程式为:______________________。
(2)氯气有毒,实验室通常用NaOH溶液吸收氯气,有关反应的离子方程式为:
_________________________________________________________________。
(3)用氢氧化铝治疗胃酸过多:_____________________________________
(1)下列4组物质均有一种物质的类别与其它三种不同
A.CaO、Na2O、CO2、CuOB.H2、C、P、Cu
C.O2、Fe、Cu、ZnD.HCl、H2O、H2SO4、HNO3
以上四组物质中类别不同的物质依次是(填化学式)(各1分)
A ______;B __;C;D 。
(2)写出下列物质在水溶液中的电离方程式:(各1分)
①氨水_________________________________________________________
②硫酸_________________________________________________________
③氢氧化钡_____________________________________________________
④硫酸铁_______________________________________________________
(3)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。(各2分)
A组:。B组:。
糖类、蛋白质是基本的营养物质,在我们的生活中扮演着及其重要的角色。如何正确识别这些物质的真伪,既检验同学们将化学知识应用于社会生活实际的能力,又可以减少伪劣物品对我们生活质量产生的负面影响。请选择下列鉴别试剂或鉴别方法:
| A.新制氢氧化铜 | B.碘水 | C.浓硝酸 | D.银氨溶液 E、燃烧 |
以及实验现象:① 烧焦羽毛味; ② 蓝色;③ 银镜(析出银);④黄色;
⑤ 砖红色沉淀用相应的序号填写下表:
葡萄糖是人体内最重要的供能物质,粮食中的糖类在人体中能转化成葡萄糖而被吸收。一部分葡萄糖在体内被氧化分解,最终生成二氧化碳和液态水,同时释放出能量,写出葡萄糖在体内氧化的化学方程式
油脂是一种重要的营养物质,在人体内水解生成高级脂肪酸和甘油(丙三醇),油脂的结构可表示为:__________________________________________。