工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为: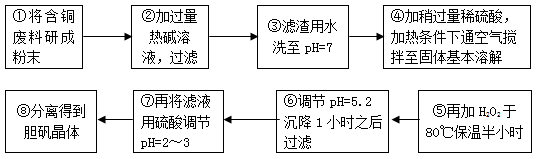
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Cu(OH)2 |
Mg(OH)2 |
Fe(OH)2 |
| pH |
5.2 |
3.1 |
6.7 |
9.4 |
9.7 |
回答:
(1)步骤①中为什么要将含铜废料研磨成粉状?
 。
。
(2)步骤⑤中H2O2参加反应的离子方程式:  。
。
(3)步骤⑥中调节溶液pH时适宜的物质是 。(填序号);
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
步骤⑥中滤渣成份的化学式 。
(4)步骤⑦中用硫酸调节pH=2~3的原因是 。
(5)步骤⑧的分离操作是: , 冷却结晶, 。
密度1.18g/cm3的MgCl2溶液中Mg2+的质量分数为5.1﹪,则500mL该溶液含有Cl-的物质的量为 。
标准状况下,设448LHCl气体溶于Wg水后得溶液密度为1.19 g/mL,且该溶液物质的量浓度为11.9mol/L,则W的值是 。
标准状况下,某双原子气体R的密度为1.25 g/L,则R的化学式可能是 。
①配平:□KMnO4+□HCl→□KCl+□MnCl2+□Cl2+□□;
②0.2mol/LNaHSO4溶液中H+浓度为0.2mol/L,该溶液与0.1mol/LBa(OH)2溶液等体积反应时的离子方程式为 。
一定温度压强下,a L氧气含有b个原子,此时c L氧气的质量是 g