下图是煤化工产业链的一部分,试运用所学知识,解决下列问题: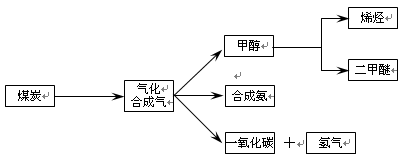
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g)  2CO(g),K1
2CO(g),K1
CO(g)+H2O(g)  H2(g)+CO2(g),K2
H2(g)+CO2(g),K2
C(s)+H2O(g)  CO(g)+H2(g),K3
CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)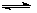 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
该反应的逆反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为 。
(3)对于反应N2O4(g)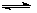 2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。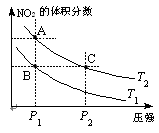
A.两种不同的温度比较:T1 > T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g) + NO2(g) + 2NH3(g)  2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)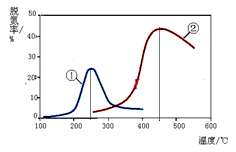
 以下说法正确的是(注:脱氮率即氮氧化物转化率)
以下说法正确的是(注:脱氮率即氮氧化物转化率)
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮
(11分)下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
| 编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
| 名称 |
酒精 |
醋酸 |
火碱 |
食盐 |
铜导线 |
亚硫酸酐 |
苏打 |
| 主要 成分 |
CH3CH2OH |
CH3COOH |
NaOH |
NaCl |
Cu |
SO2 |
Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):
属于盐的是,属于电解质的是,属于非电解质的是;
(2)写出过量②的水溶液与⑦反应的化学方程式,
少量盐酸与⑦反应的离子方程式。
⑶某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
请标出电子转移的方向和数目;当电子转移0.1mol时,消耗还原剂的质量为g。
(2分) NaCl,NaBr,NaI三种溶液可用一种试剂将它们鉴别出来,这种试剂是。
如下图所示,将活性炭投入盛满黄绿色氯气的集气瓶中,立即塞上单孔塞。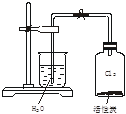
(1)轻轻摇动集气瓶,可看到的现象是_________。
(2)打开橡皮管上的夹子,看到的现象是_________。
(3)上述实验现象表明____________________________。
下列物质中,互为同分异构体的有。
互为同素异形体的有。
属于同位素的有。
属于同一种物质的有。
①液氯 ②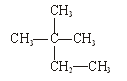 ③白磷 ④氯气
③白磷 ④氯气
⑤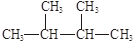 ⑥氯水 ⑦
⑥氯水 ⑦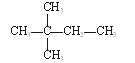
⑧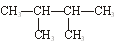 ⑨
⑨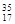 Cl ⑩红磷
Cl ⑩红磷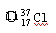
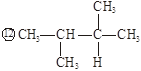
几种有机物的结构简式分别如下:
①CH3-CH=CH2 ②CH3-CH2-CH3③CH3-CH=CH-CH3 ④CH3CH2CHO(丙醛)
⑤CH3-CO-CH3(丙酮) ⑥CH3-CH2-CH=CH2
(1)请分别写出它们的分子式。
(2)指出其中属于同分异构体的物质。