A. B. C.为三种单质,B. C反应的产物溶于水得到的无色酸性溶液E,A. B反应的产物D溶于水得到黄色溶液,G为红褐色沉淀,各反应物之间的转化关系如图所示: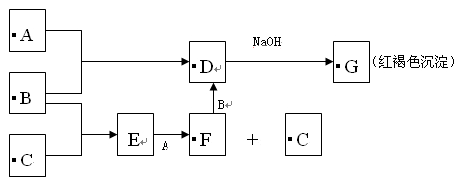
(1)A.B.C分别是 , , 。(填化学式)
(2)写出B+F → D的化学方程式: 。
(3)写出E+A → F+C的离子方程式: 。
(4)将NaOH溶液滴加到E溶液中,可观察到沉淀的颜色由白色变成灰绿色,最后变成红褐色,原因为 。(请用化学方程式表示)
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
聚合铝(PAC)的分子式为[Al2(OH)aCl b]m,聚合铝中OH-与Al3+的比值对净水效果有很大影响,定义盐基度B=n(OH-)/3n(Al3+),当B=2/3时,b =(填入合适数字)。
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
用36.5%的盐酸配制20%的盐酸,操作步骤是(依次写出),配制过程中所需的定量仪器是。
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
写出铝、氧化铝分别与盐酸反应的离子方程式:
,,
A是该周期中(除稀有气体元素外)原子半径最大的元素,从原子结构上看其原因是________________________________________________。A、B、C三元素形成简单离子的半径大小顺序为____________。(用离子符号表示)
比较A、B单质活泼性的实验方法是__________________________________________。
已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素外)原子半径最大的元 素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
1.A原子的结构示意图为__________;A元素在周期表中位置为_____________________。
2.写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式_______________________________________。
3.A和C形成的化合物的电子式为_____________,该化合物的水溶液呈__________性(填“酸”或“碱”)。