某同学欲探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铁、铜反应的实验中的有关问题。
(1)在常温下,分别向盛有等量铁片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能观察到发生明显反应的是(填序号,下同) ,无明显反应现象的是 。
(2)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能观察到随即发生剧烈反应的是 ,开始不反应,加热后发生反应的是 ,加热也不发生反应的是 。能缓慢发生反应或微热时能发生反应的是 ,反应的离子方程式为: ;
先将铜与浓硫酸反应产生的气体X持续通入下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括 。
a.通入X气体后先产生白色沉淀后溶解
b.通入X气体后溶液中无明显现象
c.通入Y气体后有沉淀产生
d.通入Y气体后沉淀溶解
e.通入Y气体后溶液中无明显现象
(3)若将(2)的Ba(OH)2换为氢硫酸,则通入X气体后的现象为 ,反应的化学方程式为 。
在学习了铜元素的性质之后,小明同学做了H2O2与铜的有关探究实验:
实验一:将铜丝置于装有H2O2溶液的试管中,没有气体产生;加热溶液时,观察到铜丝表面产生大量气体。
实验二:将铜丝置于装有硫酸酸化的H2O2溶液的试管中,溶液迅速变蓝。同时产生大量气体。
请回答下列问题:
(1)上述实验一(加热时)、实验二中铜丝表面均产生了大量气体,该气体是。
(2)写出在酸性条件下H2O2氧化铜丝的离子方程式:。
(3)H2O2能发生多种化学反应,等物质的量的H2O2在仅作氧化剂的反应、仅作还原剂的反应和分解反应中转移的电子数目之比为。
小明同学设计了以废铜屑制取硫酸铜的三个方案:
①认为最佳方案是。
②简述另两个方案的不足之处:。
高锰酸钾是一种重要的化工产品。如图是工业上用软锰矿制备高锰酸钾的一种工艺流程。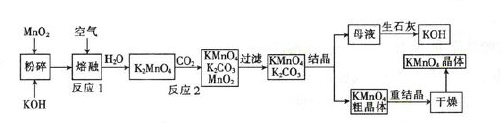
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒机理与(填字母)相似。
| A.75%酒精 | B.O3 | C.二氧化硫 | D.漂白粉 |
(2)写出上述流程中反应2的化学方程式:__
(3)上述流程中可以循环使用的物质有CO2、和。(填化学式)
(4)若不考虑制备过程中的损失和整套装置的物质循环,则1 molMnO2可制得___gKMnO4。
甲容器中发生了某化学反应,测得反应过程中,容器中存在Na+、H2O、CN-、ClO-、HCO3-、N2、Cl-七种粒子,其中ClO-和N2的物质的量随时间变化的曲线如图所示。根据题意完成下列填空:
(1)CN一中氮元素的化合价是。
(2)甲容器中发生反应的离子方程式是。该反应的氧化产物是(填化学式)。
(3)乙容器中用ClO2代替ClO-,溶液呈碱性,若最终两容器中N2的物质的量相同。则甲、乙两容器中参加反应的氧化剂的物质的量之比为。
X、Y、Z、W是元素周期表前四周期的常见元素,其相关信息如下表:
| X |
X的一种核素的质子数为56,中子数为30 |
| Y |
海水中元素含量最高的金属元素 |
| Z |
常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
| W |
价电子的排布式为3s23p3 |
(1)Z元素在元素周期表中的位置为,Z的电负性比W的(填“大”或“小”)。
(2)X元索的基态原子电子排布式是 _,其有___种运动状态不同的电子。该元素的白色氧氧化物在空气中会迅速变成灰绿色。最后变成红褐色、其反应的化学方程式为。
(3)Y的单质在工业上用途广泛,工业上以YW制取Y单质的化学方程式为。
(4)设计实验验证Z和W的非金属性的强弱:。
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO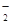 、MnO
、MnO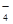 、CO
、CO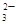 、SO
、SO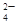 中的若干种离子组成,取溶液进行右图实验:
中的若干种离子组成,取溶液进行右图实验: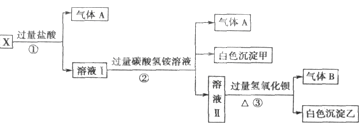
(1)白色沉淀甲是。
(2)X溶液中一定存在的离子是。
(3)白色沉淀乙中一定有:,可能有。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的化学方程式。