某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水。与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+
甲同学设计的实验方案如下: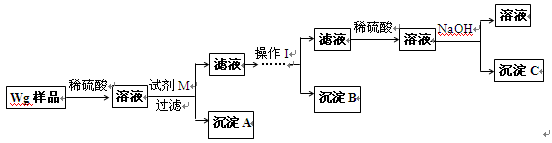
(1)方案中试剂M是 ;沉淀B是 。
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(3)若金属中含铝,则沉淀 (选填沉淀编号)的质量不为零;若金属中含锌,则沉淀 (选填沉淀编号)的质量不为零。
(4)乙同学对甲同学的方案做了如下改进:
与甲同学的方案相比,此方案的优点有 。
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是 。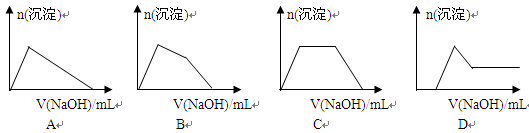
(6)上题中当沉淀质量最大时,溶液呈 (从下列选项中选填,下同);当沉淀只有一种成分时,溶液可能呈 。
| A.酸性 | B.中性 | C.碱性 | D.可能酸性,也可能碱性 |
在一密闭容器中,发生可逆反应
aA(g)+bB(g) cC(g)+dD(g)
cC(g)+dD(g) 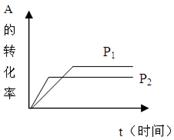
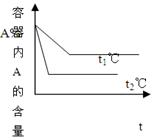
试据图回答:
(1)压强P1P2,a+bc+d(填<、>、=)
(2)温度t1℃比t2℃(填高或低),正方向为反应。(填放热或吸热)
在密闭容器中,通入xmolH2和ymolI2(g),存在H2+I2(g) 2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)
2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)
①升高温度,反应速率将,平衡将移动。
②加入催化剂,反应速率将,平衡将移动。
③充入更多的H2,反应速率将,平衡将移动。
④扩大容器的体积,反应速率将,平衡将移动。
⑤容器容积不变,通入氖气,反应速率将,平衡将移动。
(1)Mg(OH)2中混有的Al(OH)3的杂质可以用NaOH除去,请用离子方程式表示____________________
(2) Fe3+的检验用离子方程式表示___________________
(3) 在配制硫酸亚铁溶液时,常常加入铁粉,请说明原因____________(用离子方程式表示)
(4) 硫化钠水溶液显_____性(填酸、碱、中),原因_______________(用离子方程式表示)
(5) 写出镁条在二氧化碳中燃烧的化学方程式____________________
⑴事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是____________________________。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)=2H2O(1)△H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
⑵以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为_______________。
⑶电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为____________________________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
I.如图1为向25mL 0.1mol·L—1NaOH溶液中逐滴滴加0.2mol·L-1CH3COOH溶液过程中溶液pH的变化曲线。请回答:
⑴ B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间(若正确,此问不答)。
⑵关于该滴定实验,从下列选项中选出最恰当的一项________(选填字母)。
| 锥形瓶中溶液 |
滴定管中溶液 |
选用指示剂 |
选用滴定管 |
|
| A |
碱 |
酸 |
酚酞 |
(乙) |
| B |
酸 |
碱 |
甲基橙 |
(甲) |
| C |
碱 |
酸 |
石蕊 |
(甲) |
| D |
酸 |
碱 |
酚酞 |
(乙) |
⑶ AB区间,c(OH—)>c(H+),则c(OH—)与c(CH3COO—)大小关系是________。
A.c(OH—)大于c(CH3COO—) B.c(OH—)小于c(CH3COO—)
C.c(OH—)等于c(CH3COO—) D.上述三种情况都可以
⑷在D点时,溶液中c(CH3COO—)+c(CH3COOH)________2c(Na+)(填“>”“<”或“=”)。
Ⅱ.t℃时,某稀硫酸溶液中c(H+) = 10—a mol·L—1,c(OH-) = 10—b mol·L—1,已知a+b=13:
⑸该温度下水的离子积常数Kw的数值为________。
⑹该温度下(t℃),将100mL 0.1mol·L—1的稀H2SO4与100mL 0.4mol·L—1的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH=________。