在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按下图所示的操作步骤进行提纯。
已知Cu2+、Fe2+在pH=4~5时不水解,而Fe3+几乎完全水解而沉淀。
(1)加入氧化剂的目的_______________;
(2)下列物质都可以作为氧化剂,其中最适合本实验的是_____;
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
(3)物质Y是_________,加入Y的目的______________,沉淀E是_______________;
(4)欲将CuCl2•2H2O加热制得无水CuCl2,要采用什么方法和措施?_______________________
工业利用上述信息,按图所示的路线合成物质M(结构简式如右图所示),该物质是一种香料。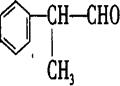
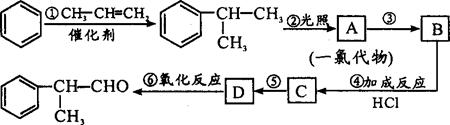
请根据上述路线,回答下列问题:
(1) A的结构简式可能为:(只写一种)。
(2) M中含氧官能团的名称是。
(3) 写出反应④的化学方程式为(有机物写结构简式,并注明反应条件):
_______________________________________________ _______。
(4) 写出D和浓硫酸共热发生消去反应的化学方程式
(5)这种香料具有多种同分异构体,写出其中一种能同时满足下列条件的同分异构体结构简式_________________________________。
a.该物质的水溶液遇FeCl3溶液呈紫色;
b.分子中有苯环,且苯环上的一溴代物有两种。
已知A可用做果实催熟剂,A的产量是衡量一个国家石油化工生产水平的重要标志。F的结构简式为CH 2=CHCl,G为高分子化合物。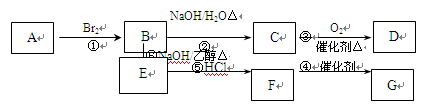
请分析后回答下列问题:
(1)E的结构式是。
(2)上述反应中属于加成反应的有。(填序号)
(3)依次写出反应②、③、④的化学方程式
_______________________________________________ _______;
_______________________________________________ _______;
______________________________________________________。
下列物质是几种常见香精的主要成分

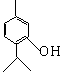
桂醛 薄荷脑 百里香酚
(1)薄荷脑的分子式为。
(2)鉴别薄荷脑和百里香酚,可选用的试剂是。
(3)下列对于桂醛的说法不正确的是_______________。
| A.可发生加聚反应 | B.可发生取代反应 |
| C.可发生氧化反应 | D.最多可与1molH2发生加成反应 |
(4)写出百里香酚与足量浓溴水反应的化学方程式
_______________________________________________ _______。
(5)写出往百里香酚钠溶液中通入CO2气体的化学反应方程式
_______________________________________________ _______。
请按要求填写:
(1)羟基的电子式。
(2)相对分子质量为58的烃中,沸点较低的物质的结构简式。
(3)写出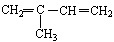 与Br2按物质的量之比1:1发生1,4加成反应方程式
与Br2按物质的量之比1:1发生1,4加成反应方程式
_______________________________________________ _______。
(4)写出甲苯的硝化反应的化学方程式
_______________________________________________ _______。
)实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成__________________________;
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成__________________________;写出甲装置中发生的主要反应的化学方程式___________________________。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,其作用是_________。
(3)下列药品中能够用来证明反应结束后的试管中确有余酸的是_________ (填写字母编号,有几个写几个,多写或写错0分)。
| A.铁粉 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
(4)实验完毕后,取少量乙试管中溶液于试管中加热,现象是___;原因是___________________________。