下列反应一定有沉淀生成的是:
| A.将SO2通入BaCl2溶液中 | B.将NH3通入AgNO3溶液中 |
| C.将Cl2通入AgNO3溶液中 | D.将NO2通入Ca(OH)2溶液中 |
NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,生成N2和CO2,对此反应的下列叙述中正确的是()
| A.使用催化剂不能加快反应速率 |
| B.降低压强能加快反应速率 |
| C.升高温度能加快反应速率 |
| D.改变压强对化学反应速率无影响 |
下列物质中,既含有离子键,又含有共价键的是()
| A.MgCl2 | B.NH4Cl | C.Na2O | D.H2O2 |
下列表示正确的是()
| A.HClO的结构式:H—O—Cl |
B.H2O2的电子式: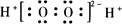 |
C.CO2的比例模型: |
D.14C的原子结构示意图: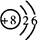 |
下列用品的有效成分及用途对应错误的是()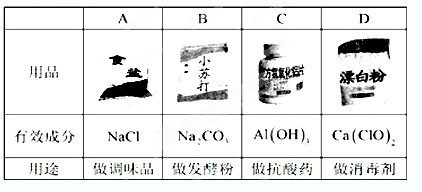
下列事实与氢键有关的是
| A.水加热到很高温度都难以分解 |
| B.水结成冰体积膨胀,密度变小 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D.NH3的热稳定性比PH3强 |