下列各表述与示意图一致的是( )
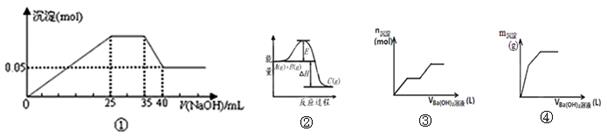
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol•L-1 |
| B.图②中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)是,△H>0,若使用正催化剂,E值会减小 |
| C.图③可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
| D.图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
25℃时,将氨水与氯化铵溶液混合得到 c(NH3·H2O)+c(NH4+) = 0.1mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是
| A.W点表示溶液中:c(NH4+) +c(H+) = c(Cl-)+c(OH-) |
| B.pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1mol·L-1 |
| C.pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+) |
| D.向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-) >c(NH4+) >c(H+) |
在探究SO2的性质实验中,下列根据实验现象得出的结论不正确的是
| A.向SO2水溶液中滴加Ba(NO3)2溶液,产生的白色沉淀是BaSO3 |
| B.向溴水中通入SO2,溶液褪色,说明+4价硫具有还原性 |
| C.将过量的SO2通入石蕊溶液中,溶液由紫色变为红色,说明SO2不能漂白石蕊 |
| D.向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3 |
化合物C是制备液晶材料的中间体之一,它可由A和B在一定条件下制得
下列说法正确的是
| A.每个A分子中含有1个手性碳原子 |
| B.可以用酸性KMnO4溶液检验B中是否含有醛基 |
| C.1molC分子最多可与4molH2发生加成反应 |
| D.C可发生加成反应、取代反应、氧化反应、消去反应 |
下列有关说法正确的是
| A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D.加热0.1 mol·L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
已知:①2H2(g)+O2(g)=2H2O (g)△H1
②3H2(g)+Fe2O3(s)=2Fe(s)+3H2O (g)△H2
③2Fe(s)+3/2O2(g)=Fe2O3(s)△H3
④2Al(s)+3/2O2(g)=Al2O3(s)△H4
⑤2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是
| A.△H1<0,△H3>0 | B.△H5<0,△H4<△H3 |
| C.△H1=△H2+△H3 | D.△H3=△H4+△H5 |