下列叙述Ⅰ和Ⅱ均正确并有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
乙二酸可与KMnO4溶液发生反应 |
乙二酸具有酸性 |
| B |
向氯化钙溶液中通入足量的CO2有 白色沉淀生成 |
CaCO3不溶于水 |
| C |
1-己醇的沸点比己烷的沸点高 |
1-己醇和己烷可通过蒸馏初步分离 |
| D |
Na在Cl2中燃烧的生成物含离子键 |
NaCl固体可导电 |
已知铝与O2、O3在一定条件下均能反应,且都生成Al2O3。反应的热化学方程式如下:
4Al(s)+ 3O2(g)===2Al2O3(s);△H=-Q1 kJ/mol
4Al(s)+ 2O3(g)===2Al2O3(s);△H=-Q2 kJ/mol。Q1、Q2均大于0,且Q1<Q2,下列说法正确的组合是()
①上述两个反应均为吸热反应;
②4mol固态Al和3mol气态O2所具有的总能量大于2mol固态Al2O3所具有的能量;
③等质量的O2、O3,O2的能量高;④等物质的量的O2、O3,O3的能量高;
⑤由O2生成O3的反应为放热反应;⑥由O2生成O3的反应为吸热反应;
①②④ B.②④⑥ C.②③⑤ D.③④⑥
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)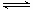 CH3CH2OH(g)+3H2O(g)下列叙述错误的是
CH3CH2OH(g)+3H2O(g)下列叙述错误的是
A.反应需在300℃进行可推测该反应是吸热反应
B.B. 使用Cu-Zn-Fe催化剂可大大提高生产效率
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
下列说法中正确的是()
| A.物质发生化学反应时不一定都伴随着能量变化 |
| B.伴有能量变化的变化都是化学变化 |
| C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
| D.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 |
下列措施有利于反应:N2 (g) + 3H2 (g)  2NH3 (g) △H = -92kJ·mol-1平衡向正反应方向移动的是( )
2NH3 (g) △H = -92kJ·mol-1平衡向正反应方向移动的是( )
①升高温度②降低温度③增大压强④减小压强
⑤增大NH3浓度⑥减小NH3浓度
| A.②④⑥ | B.①③⑥ | C.②③⑤ | D.②③⑥ |
下列有利于反应自发进行的是()
①应吸热②反应放热③反应后熵增加④反应后熵减小
| A.①③ | B.②③ | C.②④ | D.①④ |