高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是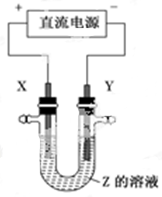
| A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
不能实现下列物质间直接转化的元素是
| A.碳 | B.氮 | C.硫 | D.铝 |
下列物质性质与应用对应关系正确的是
| A.浓硫酸具有脱水性,可用于干燥CO2 |
| B.氨气具有还原性,可用于检查HCl泄漏 |
| C.四氯化碳密度比水大,可用于萃取溴水中的Br2 |
| D.氧化铝具有高熔点,可用于生产耐火砖 |
A、B、C、X均为中学化学常见的物质,一定条件下,它们有如下转化关系(部分产物已略去),下列说法错误的是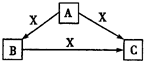
A.若X为Cl2,则C可能为FeCl3
B.若X为KOH溶液,则A可能为AlCl3溶液
C.若X为O2,则A可能为H2S或NH3
D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
甲、乙、丙、丁四种物质中,均含有相同的某种元素。在一定条件下它们之间存在如下转化关系:下列说法中错误的是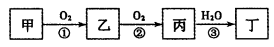
| A.甲可能是单质,也可能是化合物 | B.丁可能是酸,也可能是碱 |
| C.反应①②一定是氧化还原反应 | D.反应③一定是化合反应 |