利用钛白工业的副产品FeSO4(含少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
已知:①5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
②5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有___________;
(2)滤液经处理可得到副产品___________;
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2mol/L的H2SO4溶解
步骤2:用0.2000mol/L标准KMnO4溶液与其反应,消耗其体积30.40mL。
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2mol/L的H2SO4溶液,将Fe3+还原为Fe2+
步骤4:过滤,滤液用上述标准KMnO4溶液进行反应,消耗溶液10.00mL.
则样品中C2O42-的物质的量为__________;(写出计算过程);
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为__________;
下面是某高分子有机物的合成路线,Ⅲ、V为Ⅵ的单体。
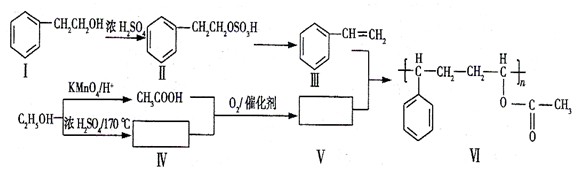
回答下列问题:
(1) 由Ⅱ生成Ⅲ的反应类型名称为。
(2)下列关于化合物I、Ⅱ和Ⅲ的说法中,正确的是(填字母)。
A.化合物I可以发生氧化反应B.化合物I不能与Na反应生成氢气
C.从I→Ⅱ和Ⅱ→Ⅲ两反应来看,I→Ⅲ过程中浓硫酸有催化剂的作用
D.化合物Ⅲ与HCl加成,只能生成一种有机产物
(3)化合物V是(填字母)类化合物。
A.醇 B.烷烃 C.烯烃 D.酸E.酯
(4)在上述合成路线中,化合物Ⅳ和CH3COOH在催化剂的作用下与氧气反应生成V和水,写出反应方程式。
(5)下图为分离化合物V、乙酸和乙醇混合物的实验操作流程图:
在上述实验过程中,所涉及的三次分离操作分别是。
A.①蒸馏②过滤③分液B.①分液②蒸馏③蒸馏
C.①蒸馏②分液③分液D.①分液②蒸馏③结晶、过滤
(6)写出I的同分异构体中能让FeCl3溶液显紫色的任意一种结构简式:
。
(7)写出反应III+V→VI的化学方程式:(不要求写反应条件)
。
(I)多项选择题
关于化工生产的下列叙述中,正确的是 。
| A.生产普通玻璃的原料是石灰石、石英、纯碱,在玻璃熔炉中发生复杂的物理化学变化 |
| B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 |
| C.加热法只适用于软化暂时硬度的硬水 |
| D.工业上采用电解熔融氯化铝生产金属铝 |
E.用高纯度焦炭与石英砂反应可制得纯度达到9个9的单晶硅材料
(II)
工业上制取硝酸铵的流程图如下,请回答下列问题: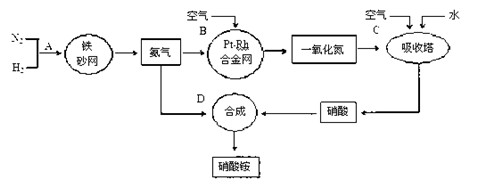
(1)1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下: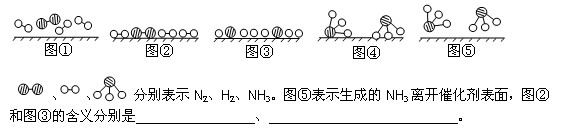
(2)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理: 碱液吸收法:NO+NO2+2NaOH===2NaNO2+H2O
碱液吸收法:NO+NO2+2NaOH===2NaNO2+H2O
NH3还原法:8NH3+6NO2 ="======" 7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(5)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表。
| 注意事项 |
理由 |
|
| ① |
||
| ② |
(I)多项选择题
CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是 。
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp2杂化,所有原子均共面 |
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(II)
锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置: 周期, 族, 区。
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ;葡萄糖分子中碳原子杂化方式有 。
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。
(4)右上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
(I)多项选择题
莽草酸是一种合成治疗甲型H1N1流感药物达菲的原料。鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机物的说法不正确的是 。
| A.两种酸都能与溴水反应 |
| B.两种酸遇三氯化铁溶液都显紫色 |
| C.鞣酸分子与莽草酸分子相比多了两个碳碳双键 |
| D.等物质的量的两种酸与足量金属钠反应时,产生氢气的量相同 |
E.等物质的量的两种酸与足量氢氧化钠溶液反应时,消耗氢氧化钠的量相同
(II)
近年来,金属有机化合物的研究越来越引起化学家的重视,其研究成果已应用于有机合成。
(一)二茂铁[Fe(C5H5)2]是铁的一种金属有机化合物,结构如图(E表示铁),其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: 。核磁共振法能够区分这两种结构,在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构,在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
(二)Grignard试剂是镁的一种金属有机化合物,它的合成方法是:
RX+Mg RMgX(Grignard试剂)
RMgX(Grignard试剂)
生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:(提示:H的一氯代物只有3种)
请按要求填空:
(1)3,4-二甲基-3-己醇的结构简式是 ,它是图示中的哪种物质 (填A~J的符号)。
(2)C+D→E的反应类型是______________,F→G的反应类型是________________。
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B: 。
(4)图示中的二元酸的名称是 ;I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物。试写出此高聚物的结构简式 。
有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与Br2的四氯化碳溶液发生加成反应,1 mol A能与1molNaHCO3溶液恰好完全反应。B所含元素种类与A相同,相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13%。试回答下列问题:
(1)A中所含官能团的名称为 。
(2)B的分子式为 ,B的同系物D的相对分子质量为60,则D可能的结构简式为 。
(3)A与B反应生成C的化学方程式为 ,该反应属于 反应。
(4)A、B的混合物共1mol,无论二者以何种比例混合,完全燃烧时下列量始终为定值的是 。
a.消耗氧气的量 b.生成水的量 c.生成二氧化碳的量