下列反应的离子方程式书写正确的是
| A.氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O = AlO+4NH+2H2O |
| B.浓烧碱溶液中加入铝片:Al+2OH-= AlO+H2↑ |
| C.用浓NaOH溶液溶解Al2O3:2OH-+Al2O3 = 2AlO+H2O |
| D.向NaAlO2溶液中通入过量的CO2:2 AlO+CO2+3H2O = 2Al(OH)3↓+CO32- |
质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为( )
| A.大于2c mol/L | B.等于2c mol/L |
| C.小于2c mol/L | D.在c mol/L一2c mol/L之间 |
下列实验操作与事故处理错误的是( )
| A.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 |
B.用试管夹从试管底由下往上夹住离试管口约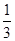 处,手持试管夹长柄末端,进行加热 处,手持试管夹长柄末端,进行加热 |
| C.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
| D.把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中 |
某物质A加热分解,产物都是气体,化学方程式为2A B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
A.7d B.5d C.2.5d D.2d
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是( )
A.次磷酸的电离方程式为H3PO2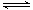 3H++PO23- 3H++PO23- |
| B.次磷酸中P的化合价为+1 |
| C.NaH2PO2是酸式盐 |
| D.NaH2PO2溶液显弱酸性 |
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3纳米)恢复了磁性,“钴酞菁”分子结构和性质与人体的血红素及植物体内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是( )
| A.在水中所形成的分散系属悬浊液 | B.分子直径比Na+小 |
| C.在水中形成的分散系能产生丁达尔效应 | D.“钴酞菁”分子不能透过滤纸 |