现需要0.1mol/L的NaOH溶液480mL,实验室用固体烧碱来配制,请回答:
(1)计算称取的NaOH固体的质量是 g;
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平 ⑦量筒。配制时,必须使用的玻璃仪器有 (填序号),还缺少的玻璃仪器是 ;
(3)使用容量瓶前必须进行的一步操作是 ;
(4)配制溶液时,在计算、称量、溶解、冷却后还有以下几个步骤,其正确的操作顺序为_ (填序号);①振荡摇匀;②洗涤;③定容;④颠倒摇匀;⑤转移。
(5)配制过程中,下列操作会引起结果偏高的是 (填序号);
①未洗涤烧杯、玻璃棒;
②称量NaOH的时间太长;
③定容时俯视刻度;
④NaOH溶液未冷却至室温就转移到容量瓶中。
(6)现将200mL0.01mol/LNaOH与50mL0.02mol/LCa(OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH﹣的物质的量浓度是 mol/L。
(共12分)氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:2H2O2(l)=2H2O(l)+O2(g)ΔH1 = -196.46 kJ·mol-1
H2(g)+1/2O2(g)= H2O(l)ΔH2 = -285.84 kJ·mol-1
Cl2(g)+H2(g)=2HCl(g)ΔH3 = -184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
B:【化学—选修5有机化学基础】芳香族化合物A常用来合成药物B及医药中间体G,其流程如图: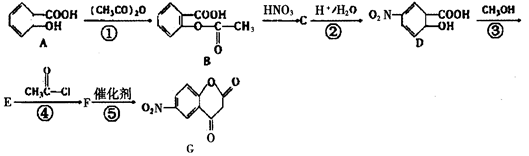
已知: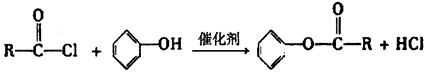
(1)D中除硝基外还含有的官能团的名称__________。D生成E的反应类型是________。
(2)鉴别A和E可用的试剂是__________________。
a.氢氧化钠溶液 b.氯化铁溶液
c.碳酸氢钠溶液 d.浓溴水
(3)反应①、③的作用____________________。
(4)写出反应⑤的化学方程式___________________。
写出F与过量NaOH共热时反应的化学方程式_________________。
(5)B有多种同分异构体,写出符合下列条件的一种物质的结构简式
①只有一种官能团
②能发生银镜反应
③苯环上的一氯取代物只有二种
④核磁共振氢谱共有四组峰,峰面积之比为3 :2 :2 :1
A.【化学—选修3.物质结构与性质】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。请填写下列空白。
(1)e元素基态原子的核外电子排布式为_____________。
(2)b、c、d三种元素的第一电离能数值由小到大的顺序为___________(填元素符号),其原因是____________。
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为___________________;分子中既含有极性共价键,又含有非极性共价键的化合物是______________(填化学式,写出两种)。
(4)已知c、e能形成晶胞如图甲和图乙所示的两种化合物,化合物的化学式为分别为:甲________________,乙___________;甲高温易转化为乙的原因是______________。
(5)这5种元素形成的一种1 :1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图丙所示)。该化合物中,阴离子为_______________,该化合物加热时首先失去的组分是______________,判断理由是________________
下表是A、B、C、D、E五种有机物的有关信息: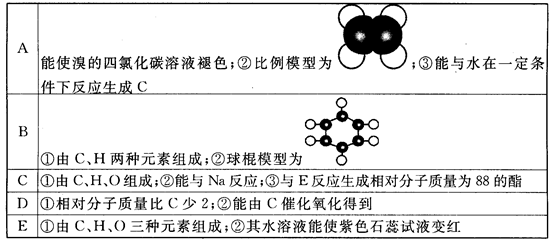
回答下列问题:
(1)A~E中,属于烃的是_____________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为___________________。
(3)C催化氧化生成D的化学方程式为_________________。
(4)有机物B具有的性质是___________(填序号)。
①无色无味的液体; ②有毒; ③不溶于水; ④密度比水大; ⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是:______________(用化学方程式说明)。
I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________。
(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____________。
(5)B与D所形成的化合物的化学键类型为______________。
(6)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_____________。
(7)实验室里除去BA2气体,可用下列试剂中的_____________(填字母)。
A.酸性高锰酸钾溶液B.浓硫酸
C.NaOH溶液D.NaHCO3溶液