有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。(已知:NH4++OH- NH3↑+H2O)
NH3↑+H2O)
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中离子的物质的量之比为______________________________。
(4)写出沉淀部分减少时的离子方程式:__________________________。
请根据官能团的不同对下列有机物进行分类。
(1)芳香烃:;(2)卤代烃:;
(3)醇:;(4)酚:;
(5)醛:;(6)酮:;
(7)羧酸:; (8)酯:。
下列各组中的两种有机物,可能是相同的物质、同系物或同分异构体等,请判断它们之间的关系。
(1)2-甲基丁烷和丁烷
(2)正戊烷和2,2-二甲基丙烷
(3)间二甲苯和乙苯
(4)1-己烯和环己烷
欲降低废水中重金属元素铬的毒性,可将Cr2O 转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如下表。
| 开始沉淀的pH |
完全沉淀的pH |
|
| Fe(OH)2 |
7.0 |
9.0 |
| Fe(OH)3 |
1.9 |
3.2 |
| Cr(OH)3 |
6.0 |
8.0 |
某含铬废水处理的主要流程如下图所示: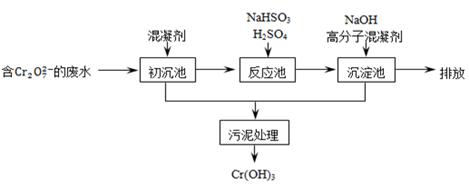
(1)Cr在周期表中的位置为。
(2)初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)。
(3)请补充并配平以下反应池中发生主要反应的离子方程式:
____Cr2O72-+ ____HSO3-+ _______ = ____Cr3+ + ___SO42-+ ____H2O。
(4)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH- = H2O和____________________。证明Cr3+沉淀完全的方法是______________________。
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。A元素的核外电子数和电子层数相等,B元素原子的核外p电子数比s电子数少1, C原子的第一至第四电离能:I1=738 kJ·mol-1、I2=1451 kJ·mol-1、I3=7733 kJ·mol-1、I4=10540 kJ·mol-1,D原子价电子层的p轨道半满,E元素的主族序数与周期数的差为4, F是前四周期中电负性最小的元素,G在周期表的第七列。
(1)BA3的电子式为________,晶体类型为。
(2)B元素基态原子中能量最高的电子,其电子云在空间有________个取向,原子轨道呈________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为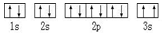 ,该同学所画的电子排布图违背了__________________。
,该同学所画的电子排布图违背了__________________。
(4)比较B和D的电负性较大的是________(填元素符号),BE3中心原子的杂化类型,其分子构型为。
(5)G位于周期表的________区,该元素的核外电子排布式为。
(6)检验F元素的方法是____________。
(1)X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布.H2在X单质中燃烧,产生苍白色火焰;Y元素的气态氢化物是H2Y,其最高价氧化物中Y的质量分数为40%;Z元素和氮元素在同一族.
①根据以上条件,推断X,Y,Z(填写元素符号);
②写出它们的最高价氧化物的水化物的化学式:X,Y,Z.
③写出Y在周期表中的位置_____________.
(2)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
a.④、⑤、⑥的原子半径由大到小的顺序是___________。
b.②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________。
c.③、④、⑥元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。用化学式表示下列4种微粒A ___________、B___________、C___________、D ___________并写出A、B、E三种微粒反应的离子方程式___________。
d.②和浓硫酸反应的化学方程式为___________