右图为某化学反应的能量-反应进程图,由此可判断该反应
| A.为放热反应 | B.为吸热反应 |
| C.属于燃烧反应 | D.属于中和反应 |
下图曲线a表示放热反应X(g)+Y(g)  Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若通过改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若通过改变起始条件,使反应过程按b曲线进行,可采取的措施是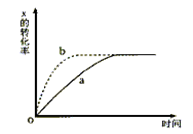
| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.扩大体积 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g) = CO2(g)+3H2(g)DH =" +" 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g) DH =-192.9 kJ·mol-1
下列说法正确的是
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的反应物总能量大于生成物的总能量 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) 的DH>-192.9 kJ·mol-1 |
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |
在容积可变的密闭容器中,2molA和8molB在一定条件下发生反应:A+3B  2C,达到平衡时,B的转化率为25%,则平衡时A的体积分数接近于
2C,达到平衡时,B的转化率为25%,则平衡时A的体积分数接近于
| A.5% | B.10% | C.15% | D.20% |
下列有关钢铁腐蚀说法正确的是
| A.钢铁腐蚀时铁作正极 |
| B.钢铁腐蚀时铁发生的反应为:Fe-3e - = Fe3+ |
| C.在碱性环境中正极反应式为:O2+2H2O +4e-=4OH- |
| D.在酸性环境中正极反应式为:O2+4H++4e-=2H2O |