已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10 mol·L-3。现向1L 0.2 mol·L-1 HF溶液中加入1L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.KSP(CaF2)随温度和浓度的变化而变化 |
| C.该体系中有CaF2沉淀产生 | D.以上说法均不正确 |
“天生我材必有用”,下列有关物质用途的叙述错误的是
| A.硝酸可用于制炸药 |
| B.氢氧化铝常用于治疗胃病 |
| C.明矾具有消毒杀菌作用,可用于净水 |
| D.硫磺有杀虫、杀螨、杀菌作用 |
下列关于物质分类的说法正确的是
| A.根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸 |
| B.根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 |
| C.铝热剂、福尔马林、水玻璃、漂白粉均为混合物 |
| D.明矾、水银、烧碱、硫酸均为强电解质 |
已知常温下Ksp(AgCl)=1.8×l0-10,Ksp(AgBr)=5×10 -13,下列有关说法错误的是
A.在饱和AgCl、AgBr的混合溶液中: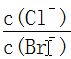 = 360 = 360 |
| B.向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀 |
| C.AgCl在水中溶解度及Ksp均比在NaCl溶液中的大 |
| D.欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol/L |
25℃时,将某一元碱MOH和盐酸溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,则下列判断不正确的是
| A.实验甲所得溶液:c(Cl-)>c(M+)>c(H+)>c(MOH) |
B.将实验甲中所得溶液加水稀释后,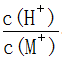 变小 变小 |
| C.a>0.10 |
D.MOH的电离平衡常数可以表示为Kb = 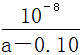 |
如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是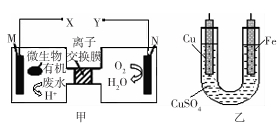
| A.质子透过离子交换膜由右向左移动 |
| B.铜电极应与X相连接 |
| C.M电极反应式:(C6H10O5)n + 7nH2O-24ne-= 6nCO2↑+ 24nH+ |
| D.当N电极消耗0.25 mol气体时,则铁电极增重16 g |