某学生对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取4g漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
 |
i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是________________________;
②由实验a、b不能判断白雾中含有HCl,理由是________________________;
(2)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,其实验方案是________________________;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是___________;
②用离子方程式解释现象ⅲ中黄绿色褪去的原因___________。
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略)。
实验过程:
①检查装置气密性后,在各仪器中添加相应试剂。
②打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
③打开活塞a,滴加一定量的浓盐酸,加热A。
④当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
⑤打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
⑥打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
⑦更换试管D,重复过程⑤,检验B溶液中的离子。

试回答下列问题:
(1)检验图中虚线框内装置气密性的具体操作是。
(2)C中发生反应的化学方程式为。
(3)B中的棉花通常会浸润试剂;实验②中通入N2的作用是。
(4)甲、乙、丙三位同学分别完成了上述实验,
他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是(填“甲”、“乙”或“丙”)。
| 过程⑤ B溶液中含有的离子 |
过程⑦ B溶液中含有的离子 |
|
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(5)进行实验过程⑥时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立: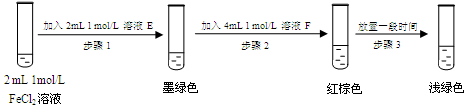
① 溶液E和F分别为、。
② 请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因。
某化学研究小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,在实验室中按以下步骤进行实验:
①称取a g样品;
②取适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL所配溶液,置于烧杯中;
④加入适量的氯水,使反应完全;
⑤加入过量氨水,充分搅拌;
⑥过滤,洗涤沉淀,并将其转移至坩埚中;
⑦加热并搅拌沉淀,至沉淀由红褐色全部变为红棕色,冷却后称量;
⑧重复步骤⑦ 的操作,直至合格为止。
请根据上面的叙述回答下列问题:
(1)下图所给仪器中,实验步骤①②③中必须用到的仪器是E和______(填仪器序号)。
(2)步骤②加入盐酸的目的是_______________________;
(3)实验步骤⑤所得沉淀为________________;步骤⑥洗涤沉淀的方法是_______________;
(4)步骤⑧合格的标准是___________________;
(5)若坩埚的质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为______;
(6)指导教师认为步骤①~⑧中有一个步骤是多余的,这个步骤是_______(填序号)。
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①检查气体发生装置A的气密性的操作是 _________________。
②整套实验装置存在一处明显的不足,请指出。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 |
实验现象 |
结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请解释Cl2过量时D中溶液红色褪去的原因,
请设计简单实验证明上述解释。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,观察到的现象是________。
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为。
(12分)已知,室温下存在反应3HNO2=HNO3+2NO↑+H2O;在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。某化学兴趣小组设计了如下Na2O2与NO反应的探究实验:
(1)装置A的试管中发生反应的化学方程式是。
(2)B瓶中不只是加入了水,还加入了一定量的铜,加铜的优点是。
(3)实验时观察到D管内固体颜色逐渐变为白色。据此甲同学认为D管中生成物是NaNO3,而乙同学认为D管中生成的是NaNO2,请设计实验证明乙同学的观点是正确的(请写出实验操作,实验现象和所对应的离子方程式)。
(4)E装置的作用是。
(5)该小组的同学经讨论认为上述装置仍有缺陷,为了避免D管中生成NaOH,你认为应该进行的改进是。
铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物。某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验。
(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是______________,
现象很壮观,取少许反应生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种结果的原因,除了可能混有没反应的磁性氧化铁外,还有一个原因是。
(2)设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝。该实验所用试剂是_________,反应的离子方程式为___________________________________________。
(3)请写出此铝热反应的化学方程式:。
每摩铝参与反应,转移的电子数为。
(4)生成除磁性氧化铁可做铝热反应实验外,下列哪些试剂也可以________。
| A.CuO | B.Na2O2 | C.MnO2 | D.MgO |