下列有关电离或离子方程式中,正确的是
A.将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O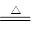 Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| B.用FeS去除废水中的Hg2+:Hg2+ + S2-=== HgS↓ |
C.用惰性电极电解MgCl2溶液: 2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
D.KHS溶液中HS-的电离:HS-+ H2O  H3O+ + S2- H3O+ + S2- |
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液无沉淀产生,加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量变为2.33g。
根据上述实验,下列推测正确的是()
| A.依据电荷守恒,推测一定存在K+和NH4+ |
| B.100mL溶液中含0.01mol CO32- |
| C.Ba2+一定不存在,Mg2+可能存在 |
| D.2.33g沉淀中含BaCO3和BaSO4 |
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。反应原理为: C3N3(OH)3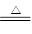 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2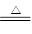 7N2+8CO2+4H2O,下列说法正确的是:()
7N2+8CO2+4H2O,下列说法正确的是:()
| A.C3N3(OH)3与HNCO为同一物质 | B.HNCO是一种很强的氧化剂 |
| C.1 mol NO2在反应中转移的电子为4 mol | D.反应中NO2是还原剂 |
氧化还原反应实际上包含氧化和还原两个过程:①向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2 + 2H2O – 2e-→ SO42-+ 4H+;②向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e-→ 2Cl-,在①和②反应中均会生成产物X,则X的化学式为()
| A.NaClO | B.HClO | C.ClO2 | D.NaClO4 |
已知下列反应① ;②
;② ;③
;③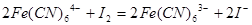
试判断下列物质的氧化性强弱顺序正确的是
A. |
B. |
C. |
D. |
为鉴别K2CO3和NaHCO3两种白色固体,有五位同学为鉴别它们,分别设计了下列五种不同的方法,其中不可行的是()
①分别取样加入1mol/L的盐酸溶液,看有无气泡产生
②分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
③分别取样配成溶液,滴加BaCl2溶液,观察有无白色浑浊
④分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
⑤分别取样配成溶液,滴加澄清石灰水,观察有无白色浑浊
| A.①③⑤ | B.②④ | C.①⑤ | D.③ |