反应A+B=2C,在反应过程中,断裂1molA中的化学键消耗的能量为Q1kJ,断裂1molB中的化学键消耗的能量为Q2kJ,形成1molC中的化学键释放的能量为Q3kJ;1molA所含化学能为E1kJ,1molB所含化学能为E2kJ,1molC所含化学能为E3kJ,下列说法中一定正确的是
| A.若E1+E2>E3,则反应为放热反应 |
| B.若Q1+Q2>Q3,则反应为放热反应 |
| C.若Q1+Q2<Q3,则反应为放热反应 |
| D.若E1+E2>E3,则反应为吸热反应 |
已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g)ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH |
C.Cl-Cl键的键能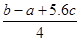 kJ·mol-1 kJ·mol-1 |
D.P-P键的键能为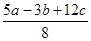 kJ·mol-1 kJ·mol-1 |
1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+236.6kJ
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+272.7kJ
由此不能判断
| A.1,3-丁二烯和2-丁炔稳定性的相对大小 |
| B.1,3-丁二烯和2-丁炔分子储存能量的相对高低 |
| C.1,3-丁二烯和2-丁炔相互转化的热效应 |
| D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小 |
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
| A.X、Y、Z、W的原子半径依次减小 |
| B.W与X形成的化合物中只含离子键 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2 个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
| A.元素X的简单气态氢化物的热稳定性比W的强 |
| B.元素W的最高价氧化物对应水化物的酸性比Z的弱 |
| C.化合物YX、ZX2、WX3中化学键的类型相同 |
| D.原子半径的大小顺序:rY >rZ >rW >rX |
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是
| A.上述四种元素的原子半径大小为W<X<Y<Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y祖传的化合物的沸点 |