在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列条件错误的是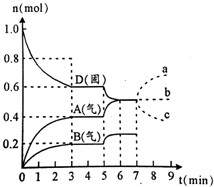
| A.从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L·min) |
B.根据图该反应的平衡常数表达式为k= 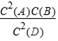 |
| C.若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 |
| D.若在第7分钟时增加D的物质的量,A的物质的量变化情况符合b曲线 |
下列有关物质应用的说法错误的是
| A.CCl4曾用作灭火剂,但因与水在高温下反应会产生有毒物质,现已被禁用 |
| B.工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的。 |
| C.Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 |
| D.为了延长果实或花朵的成熟期,可用浸泡过高锰酸钾溶液的硅土吸收水果或花朵产生的乙烯。 |
下列热化学方程式或说法正确的是 ()
| A.甲烷的燃烧热为△H=-890kJ·mol-1,则 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ∙mol-1 2NH3(g)△H=-38.6kJ∙mol-1 |
| C.已知:H2(g)+F2(g) = 2HF(g)△H=" —270" kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4︰3, Z原子比X原子的核外电子数多4。下列说法正确的是 ()
| A.W、Y、Z的氢化物稳定性顺序可能是W>Z>Y |
| B.W、X、Y、Z的原子半径大小顺序Z<Y<X<W |
| C.Z的氧化物对应水化物的酸性一定强于W氧化物对应水化物的酸性 |
| D.Z的某种氧化物可以做新型消毒剂 |
将某200ml MgCl2、K2SO4 、(NH4)2SO4的混合溶液分成两等份,取一份加入含a mol氯化钡溶液,刚好使硫酸根沉淀完全,继续加入含b mol硝酸银溶液,刚好使氯离子沉淀完全,另取一份加入含c mol氢氧化钠的溶液,恰好完全反应,则该溶液中的钾离子
的浓度为()
| A.10(b+2a-c) | B.(2b-c)/0.3 | C.(2b-a+c)/0.3 | D.10(b-c) |
将一定质量的铜粉加入到100mL,某浓度的稀硝酸中充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体336mL(标准状况) 。然后向上述混合物中加入稀硫酸至不再反应为止容器剩有铜粉m2g,则m1-m2为()
| A.5.76 | B.2.88 | C.1.44 | D.4.32 |