世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)═CO2(g)△H="-394k" J/mol
2C(石墨,s)+O2(g)═CO(g)△H="-222k" J/mol
H2(g)+ 1/2O2(g)═H2O(g)△H="-242k" J/mol
则CO还原H2O(g)的热化学方程式为_________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池的工作时的负极电极反应:_______。
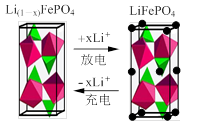
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应__________。
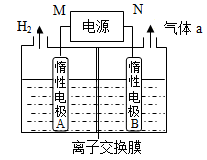
(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如上图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的________(填“正”或“负”)极,B极区电解液为_______溶液(填化学式),该离子交换膜是________(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因______________________。
尼群地平片可用于治疗高血压.其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用.它的主要成分的结构如下图,试根据结构回答下列问题:
(1) 该物质溶于水(填“能”或“不能”).
(2) 下列对该物质的描述不正确的是__________.
| A.在一定条件下能发生取代反应 |
| B.能在酸性条件下发生水解反应 |
| C.能和溴水发生加成反应 |
| D.能发生银镜反应 |
(3) 该物质在镍催化的条件下最多可以和mol氢气发生反应(填反应类型).
某有机物A(只含C、H、O)是一种重要化工生产的中间体,其蒸气密度是相同状况下氢气密度的83倍。试根据下列信息回答相关问题:
①A分子中碳原子总数是氧原子总数的3倍,其苯环上只有一个取代基,且取代基碳链上无支链;
②A可与NaHCO3溶液作用,产生无色气泡:
③A在一定条件下可与乙酸发生酯化反应。
请写出:
(1)A的分子式;
A的一种可能的结构简式;
A中含氧官能团的名称。
若有机物A存在如下转化关系(见下框图),请据此时A的结构回答(2)、(3)、(4)问:
(2)请写出:A→C和B→D的化学反应方程式(注明反应条件),并注明反应类型:
A→C:,
反应类型:。
B→D:,
反应类型:。
(3)A的一种同分异构体F,其苯环上有两个相邻的取代基,且能与三氯化铁溶液发生显色反应。F在稀硫酸存在下水解生成G和H,其中H俗称“木精”,是饮用假酒过程中致人失明、甚至死亡的元凶。
请写出F的结构简式:。
(4)已知H在一定条件下可被氧化成K,K的水溶液常用作防腐剂,请写出:
H→K的化学方程式:。
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置: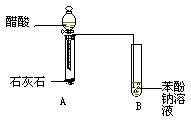
请回答下列问题
(1)仪器B中的实验现象。
(2)仪器B中的化学方程式是。
(3)该实验设计不严密,请改正。
化合物A的学名为邻羟基苯甲酸,其结构简式为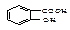 ,俗名水杨酸。
,俗名水杨酸。
⑴A跟下列哪种物质的溶液反应可得一种钠盐,其化学式为C7H5O3Na。
| A. NaOH | B.Na2SO4 | C.NaHCO3 | D.Na |
⑵水杨酸的同分异构体中,属于酚类,同时还属于酯类的化合物有种,其
结构简式分别为、、。
(7分)在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(已知气体的分压之比等于物质的量之比)。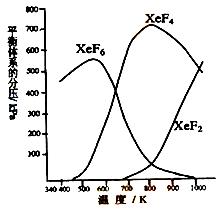
(1)420K时,发生反应的化学方程式为:________________________________________,若反应中消耗1 mol Xe,则转移电子______mol。
(2)600~800K时,会发生反应:XeF6(g) 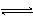 XeF4(g) + F2(g) ,其反应热△H________0(填“>”、“=”或“<”),理由是__________________________________________。
XeF4(g) + F2(g) ,其反应热△H________0(填“>”、“=”或“<”),理由是__________________________________________。
(3)900K时,容器中存在的组分有 。