现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-。为确认溶液组成进行如下实验:(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量盐酸,有2.33g沉淀不溶;(3)向(2)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是( )
| A.一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ |
| B.一定存在SO42-、CO32-、NH4+、Na+、Cl-,一定不存在K+、Na+ |
| C.c(CO32-)="0.01" mol•L-1,c(NH4+)>c(SO42-) |
| D.如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
宁夏的硒砂瓜现今已享誉区内外,西瓜富含硒元素,有延年益寿、抗衰老、抗癌作用,因之得名“硒砂瓜”。二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。在回收过程当中涉及到如下化学反应:①SeO2+4KI+4HNO3 Se+2I2+4KNO3+2H2O;②Se+2H2SO4(浓)
Se+2I2+4KNO3+2H2O;②Se+2H2SO4(浓) 2SO2↑+SeO2+2H2O。下列有关叙述正确的是
2SO2↑+SeO2+2H2O。下列有关叙述正确的是
| A.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 |
| B.①中Se是氧化产物,I2是还原产物 |
| C.反应①中KI是氧化剂,SeO2是还原剂 |
| D.反应①中每有0.6 mol I2生成,转移电子数目为2.4NA |
已知可逆反应aA+bB cC中,物质的含量R%(A%和C%)随温度的变化曲线如图所示,下列说法正确的是
cC中,物质的含量R%(A%和C%)随温度的变化曲线如图所示,下列说法正确的是
| A.该反应在T1、T3温度时达到过化学平衡 |
| B.该反应在T2温度时达到过化学平衡 |
| C.该反应的逆反应是放热反应 |
| D.升高温度,平衡会向正反应方向移动 |
肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是
| A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)ΔH=-542.7 kJ/mol |
| B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 059.3 kJ/mol |
| C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)ΔH=-1 076.7 kJ/mol |
D.N2H4(g)+ N2O4(g)=== N2O4(g)===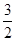 N2(g)+2H2O(g)ΔH=-1 076.7 kJ/mol N2(g)+2H2O(g)ΔH=-1 076.7 kJ/mol |
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如右图。下列叙述中正确的是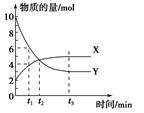
A.反应的化学方程式为5Y X X |
| B.t1时,Y的浓度是X浓度的1.5倍 |
| C.t2时,正、逆反应速率相等 |
| D.t3时,逆反应速率大于正反应速率 |
把22.4 g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是
| A.反应后生成的盐只为Fe(NO3)3 |
| B.反应后生成的盐只为Fe(NO3)2 |
| C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3 |
| D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1 |