(1)抗酸性药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。①抗胃酸药物具有抗酸作用的原因是___________,某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉.写出该抗酸药发挥功效时的离子方程式:_____、_____;
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)___________;
(2)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础,材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子材料及复合材料,生活中的玻璃、陶瓷、水泥属于上述材料中的_______,其生产原料不需要使用石灰石的是_______,我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
| 纤维编号 |
① |
② |
③ |
| 灼烧时的气味 |
特殊气味 |
烧纸气味 |
烧焦羽毛气味 |
则羊毛、棉花的编号分别为________________。
(3)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为品牌燕麦片标签中的一部分。
| 每100g含有 营养成分 |
糖类 |
油脂 |
蛋白质 |
维生素C |
钙 |
镁 |
钠 |
锌 |
| 7.6g |
7.8g |
7.4g |
18mg |
201mg |
18.2mg |
30.8mg |
8.1mg |
燕麦片的营养成分中能与水反应生成氨基酸的营养物质是________;每克营养物质氧化时放出能量最多的是________;人体必需的微量元素是________ ,“服用维生素C,可使食物中的Fe3+变为Fe2+”这句话指出,维生素C在这一反应中作_______剂。
分)(用化学符号填空:
(1)①氯化亚铁中的阳离子 ;②标出碳酸钡中钡元素的化合价 ;③三个钙原子________。
(2)①SO3中“3”的含义: ;②Mg2+中“2”的含义: 。
(3)“候氏制碱法”中的创始人 。
如图所示的是初中化学中的一些重要实验。请回答下列问题: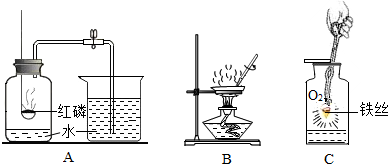
(1)实验A:测得空气中氧气体积分数小于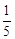 的原因可能是(只答一条): 。
的原因可能是(只答一条): 。
(2)实验B:用玻璃棒搅拌的目的是 。
(3)实验C:集气瓶内放少量水的目的是 。
在具有活塞的密闭容器中,一定温度下的可逆反应,H2(g)+I2(g)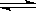 2HI(g)已达平衡,将活塞外拉,在此过程中:
2HI(g)已达平衡,将活塞外拉,在此过程中:
(1)容器颜色 (填“变浅”或“变深”)
(2)容器内的压强 (填“变大”“变小”或“不变”)
(3)混合气体的密度 (填“变大”“变小”或“不变”
某密闭容器中,有A、B两种气体,反应按下式进行A(g)+B(g)=2C(g)反应经过2s后浓度不再发生变化时,测得容器中各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75 mol/L,c(C)=0.5 mol/L。
(1)B物质的起始浓度各为
(2)2s时A的转化率
(3)用物质A表示反应的平均速率
已知下热化学方程式:
①H2(g)+1/2O2(g)= H2O(l) ⊿H= —285.8 kJ/mol
②H2(g)+1/2O2(g)= H2O(g) ⊿H= —241.8kJ/mol
③C(s)+1/2O2(g) =" CO" (g) ⊿H= —110.5kJ/mol
④C(s)+ O2(g) = CO2(g) ⊿H= —393.5kJ/mol
回答下列问题:
(1)上述反应中属于放热的是
(2)H2的燃烧热为 ,C的燃烧热为
(3)燃烧10g H2生成液态水,放出的热量为
(4)CO的燃烧热为 ,其热化学方程式为