按要求写出下列反应的符号表达式
(1)磷在空气中燃烧 ; (2)氯酸钾和二氧化锰制取氧气 ;
(3)加热碳酸氢铵 ; (4)二氧化碳通入澄清的石灰水 ;
(5)以上属于化合反应的是 (填序号)。
A~E及甲、乙均代表初中化学中的常见物质。它们在一定条件下的转化关系如图所示(部分生成物已略去)。其中A、B都是单质,常温下均为气体,B在空气中的体积分数约为21%,反应①和②均放出大量的热,乙是造成温室效应的主要气体。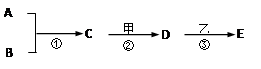 请回答:
请回答:
(1)B物质的化学式 ,D物质的俗称。(写一种)
(2)写出反应②的化学方程式。
(3)C也可转化为A和B,写出该反应的化学方程式。
下列各种叙述都是错误的,请你举一反例证明它是错误的:
| 错误的叙述 |
实例 |
| 例:组成元素相同的物质一定是同种物质 |
CO 和CO2都是由碳、氧元素组成,却是两种不同的物质。 |
| 盐的水溶液都显中性 |
|
| 单质与化合物发生的反应都是化合反应 |
|
| 同一物质中相同元素的化合价必定相同 |
|
| 含有氧元素的化合物一定是氧化物 |
完成下列变化的化学方程式,并按要求填空。
(1)“湿法冶铜”的反应:;其基本反应类型是。
(2)以赤铁矿为例,高炉炼铁的主要反应原理:。
(3)用氨水中和工厂排放废水中含有的硫酸,其基本反应类型是。
按要求写出数字和符号:(1)3个硝酸根离子,(2)+2价的铁元素___ ____,(3)人体缺__ __ _元素易得佝偻病,(4)侯氏联合制碱法中的“碱”是。
下图是物质A、B、C的溶解度曲线,试根据图像回答: 
(1)温度为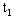 ℃时,三种物质溶解度大小关系是 (6);
℃时,三种物质溶解度大小关系是 (6);
(2)A、B、C三种物质中常温下可能是气体物质的是 (7)
(3)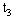 ℃时,A物质50克放入50克水,所得溶液 (8)(填“饱和溶液”、“不饱和溶液”),此时溶液的溶质质量分数为(9)
℃时,A物质50克放入50克水,所得溶液 (8)(填“饱和溶液”、“不饱和溶液”),此时溶液的溶质质量分数为(9)
(4)A中含有少量B物质,从混合物中分离得到纯净的A的实验操作是a.配制热饱和溶液,b. (10)c.过滤,d.烘干。