已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是
A.反应②中的能量变化如图所示,则ΔH2=E1-E3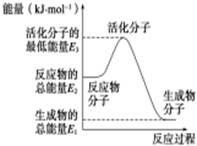 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1 |
常温下,下列各组离子在指定条件下可能大量共存的是
| A.弱碱性溶液中:Na+、K+、Cl一、HCO3一 |
| B.无色溶液中:Cu2+、K+、SO42一、NO3一 |
| C.pH=0的溶液中:ClO一、SO42一、Fe2+、K+ |
| D.由水电离的c(OH一)=10-14 mol·L一1的溶液中:CH3 COO一、SO42一、Na+、NH4+ |
短周期元素X、Y、Z在元素周期表中的相对位置如图所示,其中X原子最外层电子数是次外层电子数的3倍。下列说法错误的是
| A.元素X和元素Y的最高正化合价相同 |
| B.气态氢化物的热稳定性:H2 Y < H2 X |
| C.Y2 Z2是共价化合物 |
| D.酸性:HZO4 >H2YO4 |
下列关于有机化合物的说法正确的是
| A.分馏产品是纯净物 | B.①主要发生物理变化 |
| C.②是石油的裂化 | D.③属于取代反应 |
用NA表示阿伏加德罗常数,下列说法正确的是
| A.1 mol OH一中含有9 NA个电子 |
| B.1 L 1 mol·L-1CH3 COONa溶液中含有NA个CH3 COO— |
| C.28g CO气体中含有NA个氧原子 |
| D.常温常压下11.2 L甲烷气体含有的分子数为0.5NA |
以下四类物质,与盐酸反应不可能生成水的是
| A.氧化物 | B.碱 | C.盐 | D.金属 |