物质的量是高中化学中常用的物理量,请完成以下有关其内容的计算:
(1)标准状况下,含有相同氧原子数的CO与CO2的体积之比为______。
(2)等温等压下,等体积的O2和O3所含分子个数比为________ ,原子个数比为________ ,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g某气中含有的分子数为b,则c g某气在标准状况下的体积约是________。 (用含NA的式子表示).
(4)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g•mL-1,质量分数为98%)的体积为_______ mL.
(5)100 mL 某Al2(SO4)3溶液中,n(Al3+)=0.20 mol,则其中c( )= ______mol/L。
)= ______mol/L。
(6)某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数5.6%,300mL该溶液中Cl-的物质的量等于______ .
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊。若78克叠氮化钠完全分解,产生标准状况下氮气___________________L 。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。计算溶液中氢氧化钠的物质的量浓度______________________(忽略液体体积变化)。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O。己知通入二氧化碳112 L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5。若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量的最大值。
(4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
| 铵盐的质量/g |
10.00 |
20.00 |
30.00 |
50.00 |
| 浓硫酸增加的质量/g |
m |
m |
1.29 |
0 |
试回答:
该铵盐的成分为_______________________________。
该铵盐中氮元素的质量分数为:_______________________________(须列式计算)。
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物。甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量。
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出。(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图。分析该图像,并回答下列问题:
(1)写出ab段涉及的离子方程式:。
(2)c点对应的数值是;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为。乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收。测定结果如下表:
| 实验编号 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
| 铵盐的质量(g) |
9.88 |
19.76 |
29.64 |
49.40 |
| 浓硫酸增加的质量(g) |
m |
m |
1.36 |
0 |
分析该表,并回答下列问题:
(3)①分析实验数据可知,实验编号为的实验中,氢氧化钠足量,铵盐中的铵根离
子完全转化成气体;m的值为。
②计算样品B中氮元素的质量分数。(用小数表示,保留两位小数)
(1)乙组同学在研究时发现,浓硫酸增重的质量与样品B的质量之间满足一定的函数关系。假设样品的质量为x(g),浓硫酸增重的质量为y(g)。求:当x在不同范围时y与x的函数关系。
纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法。该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠。各步骤反应的化学方程式如下:
2NaCl+H2SO4 Na2SO4+2HCl↑
Na2SO4+2HCl↑
Na2SO4+2C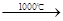 Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3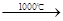 Na2CO3+CaS
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的的质量是_________kg。
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是___________________________________。若其它条件不变,步骤②按此反应进行,每获得1kg纯度为80%的纯碱需要氯化钠的的质量是__________kg,此时消耗碳单质的量是原步骤②反应用碳量的____倍。
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度。
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分, 如果加入amol氯化钠时,生成的Na2CO3为yg,电子转移数为zmol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少。
| x |
y |
z |
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)=。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是。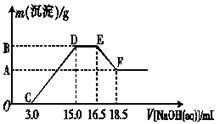
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为(最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
| 实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
| 加入钢样粉末的质量(g) |
2.812 |
5.624 |
8.436 |
| 生成气体的体积(L)(标准状况) |
1.120 |
2.240 |
2.800 |
则该硫酸溶液的物质的量浓度为。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为g (保留3位小数)
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3。
(1)在铜盐溶液中Cu2+发生水解反应的离子方程式为____,该反应的平衡常数为____;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
(2)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”)。常温下,向10mL0.01mol/L H3PO3溶液中滴加10ml0.02mol/LNaOH溶液后,溶液中各种离子浓度由大到小的顺序是_________;
(3)电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。