下列关于电解质溶液中离子关系的说法中正确的是
| A.0.1mol·L-1Na2CO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O等体积混合后离子浓度关系 c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合液溶中: c(Na+)=c(CH3COO-) |
| D.常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
反应L(s)+aG(g) bR(g)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强 P1>P2,X轴表示温度,Y轴表示平衡混合气中G的体积分数。
bR(g)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强 P1>P2,X轴表示温度,Y轴表示平衡混合气中G的体积分数。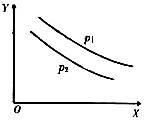
据此可判断( )
| A.上述反应是放热反应 | B.上述反应是吸热反应 |
| C.a>b | D.a=b |
一定条件下反应2AB(g) 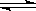 A2(g)+B2(g)达到平衡状态的标志是( )
A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
已知充分燃烧a g乙炔(C2H2)气 体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l )ΔH=-2b kJ / mol )ΔH=-2b kJ / mol |
| B.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=b kJ / mol |
| C.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)ΔH=2b kJ / mol |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-4b kJ / mol |
在密闭容器中,对于反应:2SO2(g)+O2(g)  2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
| A.10 mol和10% | B.20 mol和20% |
| C.20 mol和40% | D.20 mol和80% |
化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1mol共价键(或其逆过程)时释放(或吸收)的能量。已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 (g)+ 3H2(g) 2NH3(g)ΔH="-92.4" KJ/mol,则N≡N键的键能是 ( )
2NH3(g)ΔH="-92.4" KJ/mol,则N≡N键的键能是 ( )
| A.431 KJ/mol | B.946 KJ/mol | C.649 KJ/mol | D.869 KJ/mol |