下列反应的离子方程式书写正确的是
| A.Na2O溶于水:Na2O+H2O=2Na++2OH- |
| B.向Ca(ClO)2溶液中通入过量CO2:2ClO-+H2O+CO2=2HClO+CO32- |
| C.用FeCl3溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ |
| D.碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
下列物质分类正确的是
| A.SO2、SiO2、 CO均为酸性氧化物 |
| B.稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C.烧碱、冰醋酸、四氯化碳均为电解质 |
| D.福尔马林、水玻璃、氨水均为混合物 |
化学无处不在,下列与化学有关的说法,正确的是
| A.纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
| B.侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| C.碘是人体必须微量元素,所以要多多吃富含高碘酸的食物 |
| D.氯化铝是一种电解质,可用于电解法制铝 |
某稀溶液中含4molKNO3和2.5molH2SO4,向其中加入1.5molFe粉,充分反应后产生的NO气体在标准状况下的体积为( )
| A.36L | B.28L | C.22.4L | D.11.2L |
某固体混合物是由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):下列说法中不正确的是( )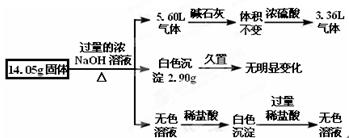
| A.该固体中一定没有FeCl2,可能含有AlCl3 |
| B.该固体中含有2.70 g Al |
| C.该固体中含有6.60 g (NH4)2SO4 |
| D.该固体中含有4.75 g MgCl2 |
X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是( )
甲:XO3n-+X n-+H+→X单质+H2O(未配平)乙:Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
| A.①③ | B.④⑤ | C.①② | D.②③ |