实验室用63%的浓硝酸(其密度为1.4g/mL)配制240mL0.50mol/L稀硝酸,若实验仪器有:A 10mL量筒 B 50mL量筒 C 托盘天平 D 玻璃棒 E 100mL容量瓶 F 250mL容量瓶 G 500mL容量瓶 H 胶头滴管 I 200mL烧杯。
(1)此浓硝酸的物质的量浓度为 mol/L
(2)应量取63%的浓硝酸 mL,应选用 。(填仪器的字母编号)
(3)实验时还需选用的仪器有(填序号)
| A.I、 (4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)。 ①量取浓硝酸的量筒用蒸馏水洗涤2~3次,丙把洗涤液转入容量瓶 ②容量瓶使用时未干燥 ③溶解后未经冷却就移液 ④定容时不小心又少量蒸馏水滴到瓶外 ⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线 (5)容量瓶是一种颈部细长的梨形瓶,哟与其颈部细长,所以在向容量瓶中移入液体时,需要一定耐心和技巧。有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是 |
| B.可以按此建议改进,便于使用容量瓶 |
| C.不能按此建议改进,因为会降低容量瓶的精确度 |
| D.不必加粗瓶颈,因为向容量平中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |
碳和碳的化合物在生产生活实际中应用广泛。运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka = 4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式;
4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式;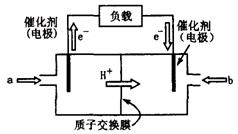
(2)上图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示 意图。电池总反应为2CH3OH+3O2
意图。电池总反应为2CH3OH+3O2 2CO2+4H2O。该装置放电时(填“a”或“b”)为电池的负极,其电极反应式为;
2CO2+4H2O。该装置放电时(填“a”或“b”)为电池的负极,其电极反应式为;
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。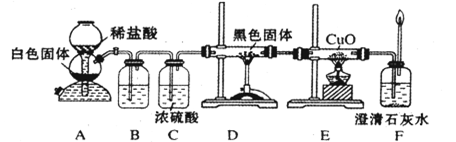
已知:C + H2O CO+H2 CO + H2O
CO+H2 CO + H2O CO2 +
CO2 +  H2 C + CO2
H2 C + CO2 2CO
2CO
试回答下列问题:
①装置B中最适宜的试剂是,必须用装置C吸收气体中的水蒸气的理由是;
②根据该实验中的现象,可证明CO具有还原性;
③若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置与之间(填字母标号)连接下图中的装置(选填序号)。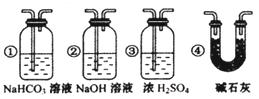
(10 分)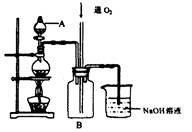
硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加人到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示)。
(1)图中烧瓶内发生的离子反应方程式为:________________
(2)反应时B瓶内的现象是___________________________
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把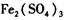 作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节
作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节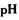 ,产生
,产生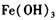 沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作
沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作 催化剂循环使用。
催化剂循环使用。
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使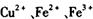 分别生成沉淀的pH如下:
分别生成沉淀的pH如下:
| 物质 |
开始沉淀时的PH |
完全沉淀时的PH |
| Fe(OH)3 |
1.9 |
3. 2 |
| Cu(OH)2 |
4. 7 |
6. 7 |
| Fe(OH)2 |
6. 3 |
9. 7 |
请回答下列问题:
①物质甲是_____ (填字母序号)。
a.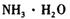 b.
b.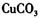 c.
c.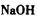 d.
d.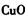
②该方案中调节PH的范围是______ 。
黄铁矿(主要成分为FeS2)曾是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O22Fe2O3+8SO2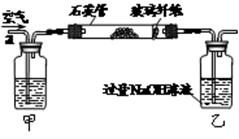
II.反应结束后,将乙瓶中的溶液进行如下图所示处理。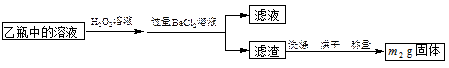
[实验二]测定铁元素的含量。
III.测定铁元素的含量的实验步骤如下图所示。
问题讨论:
(1)上述装置中,甲瓶内所盛试剂是溶液。
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为。
II中除了可以用H2O2溶液作为氧化剂,还可以加入(填序号)。
①氯水②浓H2SO4③HNO3④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填)(填“合理“或”不合理“)、(如合理,则此空不填)。
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有。
现用质量分数98%密度为1.84 g·cm-3浓H2SO4来配制450 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管
⑤量筒⑥容量瓶⑦托盘天平⑧药匙。请回答下列问题:
⑴上述仪器中,在配制稀H2SO4时用不到的有(填代号)。
⑵经计算,需浓H2SO4的体积为。
现有① 5 mL ②10 mL ③20 mL ④50 mL三种规格量筒,你选用的量筒是(填代号)。
⑶在配制过程中,下列操作错误的是(填代号),
其他操作都准确,下列操作能引起误差偏高的有(填代号)。
①将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③洗涤溶解用的烧杯与玻璃棒,并将洗涤液转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
实验室可利用乙醇、铜或铜的化合物制备乙醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是;
(2)两套装置中的A、B处都需加热,
A处用水浴加热,B处用加热,A处用水浴加热的主要优点是
(3)若按甲装置进行实验,B管处装铜粉,则通入A管的X是,
B中反应的化学方程式为。
(4)若按乙装置进行实验,则B管中应装,
B中反应的化学方程式为。
(5)实验结束后,将C试管中的溶液滴入新制的氢氧化铜溶液中并加热,可观察到的
现象,写出该过程的化学方程式。