以氨气代替氢气研发氨燃料电池是当前科研的一个热点.

(1)氨燃料电池使用的电解质溶液是2 mol·L-1的KOH溶液,电池反应为:4NH3+3O2 =2N2+6H2O。该反应每消耗1.7g NH3转移的电子数目为 ;
(2)用氨燃料电池电解CuSO4溶液,如右图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L.
(3)纳米级氧化亚铜(Cu2O)是一种重要光电材料。现用铜棒和石墨做电极,饱和食盐水做电解质制备纳米级氧化亚铜(Cu2O),电解反应为 。铜棒上发生的电极反应式为
。铜棒上发生的电极反应式为
某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。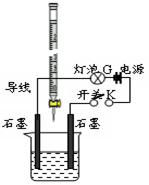
(1)实验时,烧杯中应盛(选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为,原因是。烧杯中得到的溶液pH=。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“⑵”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为__。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是______(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
Ⅰ.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
(1)反应前2 min的平均速率ν(Z)=,该温度下此反应的平衡常数K=
(2)其他条件不变,若降低温度,反应达到新平衡前ν(逆)ν(正)(填“>”,“<”或“=”)
(3)其他条件不变,若再充入0.2 mol Z,平衡时X的体积分数(填“增大”,“减小”或“不变”)
Ⅱ.下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。
请根据上述信息回答:
(1)H中含氧官能团的名称是________,B→I的反应类型为________。
(2)只用一种试剂鉴别D、E、H,该试剂是________。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为__ ______。
(4)D和F反应生成X的化学方程式为_______________。
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)c(CH3COO-)(填“>”或“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中
c(Na+) c(CH3COO-)(填“>”或“=”或“<”)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈,醋酸体积氢氧化钠溶液体积。(填“>”或“=”或“<”)
实验室用下述装置制取氯气,并用氯气进行下列实验。 回答下列问题:
(1)A、B两仪器的名称:A_________________,B________________。
B中发生反应的化学方程式为______________________________________________。
(2)洗气装置C是为了除去Cl2中的HCl气体,应放入的试剂是________________,D中浓H2SO4的作用是________________。
(3)E中为红色干布条,F中为红色湿布条,可看到有色布条褪色的是 _______。(填E或F)
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______________。
H是浸有NaBr溶液的棉花球,H处反应的化学方程式是________________________________________。
(5)P处为尾气吸收装置,写出实验室利用烧碱溶液吸取Cl2的化学方程式______________________。
标准状况下的6.4 g甲烷气体的体积为8.96 L,其物质的量为,则该气体相对分子质量为________;所含甲烷分子为个。