化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.酸性(水溶液):HSCN > H2CO3 > HCN |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |
Na2O2、CaC2、CaH2、FeS2均为离子化合物,前三种物质极易与水反应。下列叙述正确的是()
| A.CaC2与水的反应属于氧化还原反应 |
| B.CaH2在水中以Ca2+和H-的形式存在 |
| C.4种化合物晶体类型和化学键类型均相同 |
D.FeS2中S2-的电子式为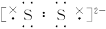 |
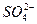 和
和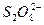 结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是()
结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是()
A.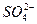 的电子式为 的电子式为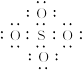 |
B.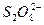 中没有非极性键 中没有非极性键 |
C.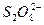 比 比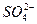 稳定 稳定 |
D.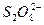 有强氧化性 有强氧化性 |
已知元素砷(As)的原子序数为33,下列叙述正确的是( )
| A.砷元素的最高化合价为+3 | B.砷元素是第4周期的主族元素 |
| C.砷原子的第3电子层含有18个电子 | D.砷的氧化物的水溶液呈强碱性 |
碳化硅(又名金刚砂)的一种晶体,具有类似于金刚石的结构,其中碳原子与硅原子位置是交替的。下列的各晶体:①晶体硅②硝酸钾③金刚石④碳化硅⑤干冰,它们的熔点由高到低的顺序是()
| A.①②③④⑤ | B.①④③②⑤ |
| C.③④①②⑤ | D.③④①⑤② |
下列事实中,一般不能用于判断金属性强弱的是()
| A.金属间发生的置换反应 |
| B.1 mol 金属单质在反应中失去电子的多少 |
| C.金属元素的最高价氧化物对应的水化物的碱性强弱 |
| D.金属元素的单质与水或酸置换出氢的难易 |