计算:常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g·cm-3的混合溶液。计算:
(1)求该混合溶液中NaCl的质量分数。
(2)求该混合溶液中NaCl的物质的量浓度。
(3)求在1 000 g水中需加几摩尔氯化钠,才能使其浓度恰好与上述混合溶液浓度相等。(保留1位小数)
在ZnS沉淀中加入10mL0.001mol/L的CuSO4溶液是否有CuS沉淀生成?(必须写出判断理由)(已知:Ksp(ZnS)=1.6×10-24mol2/L2Ksp(CuS)=1.3×10-36mol2/L2)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
①②③④⑤
称取粗盐



 滤液
滤液
⑥⑦
 精盐
精盐
(1)判断BaCl2已过量的方法是
(2)第④步中,相关的离子方程式是
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
(4)为检验精盐纯度,特配制150 mL 0.2 mol·L—1 NaCl溶液,下图是该同学转移溶液的示意图,图中的错误是
(5)提纯过程中步骤①⑤⑦都用到相同的仪器,名称:
这三个步骤中还需要用到的属于硅酸盐材料的仪器有(填写仪器名称)
(6分)在100ml NaOH溶液中加入NH4HCO3和(NH4)2SO4的固体混合物,加热充分反应。下图表示加入的混合物质量和产生的气体体积(标准状况)的关系;试计算: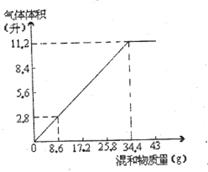
(1)NaOH溶液的物质的量浓度?
(2)当NaOH溶液的体积为l40mL,固体混合物质量是51.6g时,充分反应后,生成气体的体积为多少升?
(3)当NaOH溶液体积为180mL时,固体混和物的质量为51.6g时, 充分反应后,生成气体的体积为多少升?
充分反应后,生成气体的体积为多少升?
Fe与Fe2O3的混合物2.72g,加入到50mL 1.6mol/L盐酸中恰好完全溶解,经KSCN检验,溶液不显红色,若忽略溶液体积变化,写出反应的离子方程式, ,。
反应后溶液中Fe2+物质的量浓度是mol/ L
向一定量铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将溶液稀释到500mL,再加入足量锌粉,充分反应后,收集到2.24L(标准状况)气体,过滤残留固体,干燥后称量,质量比加入的锌粉减轻了7.5g。
试求:
(1)加入铜片的质量。(2)原硫酸的物质的量浓度(结果保留一位小数)。