下列根据实验操作和现象所得出的结论不正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性:S>C |
| B |
SO2通入酸性高锰酸钾溶液 |
高锰酸钾溶液褪色 |
SO2具有还原性 |
| C |
溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液 |
出现淡黄色沉淀 |
溴乙烷发生了水解 |
| D |
向等浓度的KBr、KI混合液中滴加AgNO3溶液 |
先出现黄色沉淀 |
Ksp(AgBr)> Ksp(AgI) |
用惰性电极电解硫酸铜溶液一段时间后,向电解池中加入0.2molCu(OH)2恰好恢复为电解前的浓度,则电解过程中转移电子的物质的量为
| A.0.8 mol | B.0.4 mol | C.0.2mol | D.0.6mol |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。
2Fe2++I2设计成如下图所示的原电池。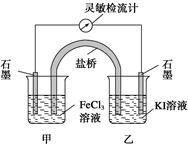
下列判断不正确的是
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.检流计读数为零时,反应达到化学平衡状态 |
| D.检流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
铁镍蓄电池放电时的总反应为:Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
已知:N2(g)+3H2(g) ===2NH3(g) ΔH=-92.4 kJ·mol-1下列说法正确的是
| A.反应中的能量变化如图所示,则ΔH=E1-E3 |
| B.若加入催化剂,将改变反应历程,从而改变ΔH |
| C.温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.若保持温度和容器体积不变,充入氦气,则压强增大,化学反应速率加快 |
下列说法正确的是
| A.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1, 则H2SO4(aq)+Ba(OH)2(aq)=== BaSO4(s) +2H2O(l) ΔH=2×(-57.3) kJ·mol-1 |
| B.已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
C.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)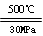 2NH3(g) ΔH=-38.6 kJ·mol-1 2NH3(g) ΔH=-38.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1 |