硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。

(1)将烧碱吸收H2S后的溶液加入到如图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S (n—1)S+ S2-
S (n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式:
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图—2所示。
①在图示的转化中,化合价不变的元素是
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图—3所示,H2S在高温下分解反应的化学方程式为
(1)8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 |
H—H |
N—H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为:。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:。
根据要求填空:
(1)只用键线来表示碳架,两根单键之间或一根双键和一根单键之间的夹角为120˚,一根单键和一根三键之间的夹角为180˚,而分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略,而其他杂原子及与杂原子相连的氢原子须保留。每个端点和拐角处都代表一个碳。用这种方式表示的结构式为键线式。写出下列有机物的键线式:
①CH3(CH2)2COOH____________________;②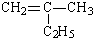 :__________________。
:__________________。
(2)写出下列原子团的电子式:①甲基 _______________;②氢氧根离子 _____________
(3)写出有机物 的名称 _______________________________________
的名称 _______________________________________
(4)在有机物分子中若某一个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”.C7H16的同分异构体中具有“手性碳原子”的有 ___________种.
(5)某有机高分子化合物的结构片段如下:
则合成它的单体是 ____________________________________。
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下: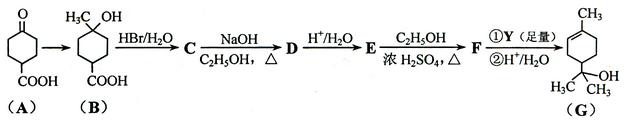
已知:RCOOC2H5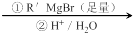
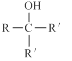
请回答下列问题:
(1)A所含官能团的名称是________________。
(2)A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:
_______________________________________________________________。
(3)B的分子式为_________;写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。
① 核磁共振氢谱有2个吸收峰② 能发生银镜反应
(4) B → C、E → F的反应类型分别为_____________、_____________。
(5)C → D的化学方程式为____________________________________________。
(6)试剂Y的结构简式为______________________。
(7)通过常温下的反应,区别E、F和G的试剂是______________和_____________。
(8)G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:________________________。
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
有关物质间转化关系如下图,试回答:
(1)转化①的反应条件为.
(2)转化②的化学方程式为.转化③的离子方程式为.
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择(填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为mL。