X、Y均为元素周期表ⅦA族中的两种元素。下列叙述中,能够说明X的原子得电子能力比Y强的是
| A.原子的电子层数:X>Y |
| B.对应的简单离子的还原性:X>Y |
| C.气态氢化物的稳定性:X>Y |
| D.氧化物对应水化物的酸性:X>Y |
对于以下反应:①KHCO3溶液与石灰水反应②Na2SO3溶液与稀盐酸反应
③Si与烧碱溶液反应 ④Fe与稀硝酸反应;改变反应物用量时,不能用同一个离子方程式表示的是
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.45 mL | C.30 mL | D.50 mL |
下列实验设计能完成或实验结论合理的是
| A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 |
| B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物 |
| C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D.用浓硫酸吸收二氧化硫中混有少量SO3气体 |
已知下列氧化还原反应:2BrO3-+Cl2==Br2+2ClO3-,5Cl2+I2+6H2O==2IO3-+10Cl-+12H+,
ClO3-+5Cl-+6H+==3Cl2↑+3H2O。上述条件下,各微粒氧化性由强到弱的排列顺序正确的是
| A.ClO3->BrO3->IO3->Cl2 | B.BrO3->Cl2>ClO3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->ClO3->IO3- |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: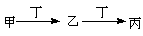 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为SO2,则丁可能是氢氧化钠溶液 |
| C.若甲为Fe,则丁可能是浓盐酸 |
| D.若甲为AgNO3溶液,则丁可能是氨水 |