根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1 = ―Q1 kJ/mol
2H2S(g)+O2(g)="2S" (s)+2H2O(l) △H 2= ―Q2 kJ/mol
2H2S(g)+O2(g)="2S" (s)+2H2O(g) △H 3= ―Q3 kJ/mol
(已知:H2S完全燃烧生成SO2,不完全燃烧生成S)判断△H1、△H2、△H3三者关系正确的是
| A.△H1>△H2>△H3 | B.△H1>△H3>△H2 |
| C.△H3>△H2>△H1 | D.△H2>△H1>△H3 |
下列图示与对应的叙述相符的是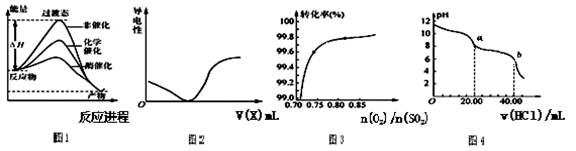
| A.由图1所示曲线可知,化学催化比酶催化的效果好 |
| B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2 |
C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 |
| D.图4是用0.l000 mol/L的盐酸滴定20.00 mL 0.l000mol/LNa2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O |
某饱和一元酯C5H10O2,在酸性条件下水解生成甲和乙两种有机物,乙在铜的催化作用下能氧化为醛,满足以上条件的酯有
| A.6种 | B.7种 | C.8种 | D.9种 |
下列反应的离子方程式正确的是
| A.过氧化钠固体与水反应制氧气:2O22—+2H2O=4OH-+O2↑ |
| B.在100ml浓度为1 mol · L-1的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O==2Fe2++SO42-+4H+ |
| C.1mo·L-1的NaAlO2溶液和2.5mol· L-1的盐酸等体积混合:2AlO2-+ 5 H+=Al(OH)3 ↓+ Al3++ H2 O |
| D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO+H+=== HCO |
下图是部分短周期主族元素原子半径与原子序数的关系图。则下列说法正确的是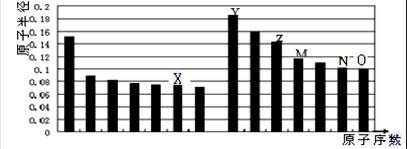
| A.Y、O两种元素的离子半径相比,前者较大 |
| B.Z的氧化物能分别溶解于Y的最高氧化物的水化物和O的氢化物的水溶液 |
| C.由X与Y两种元素组成的化合物只含离子键 |
| D.X、N两种元素的气态氢化物的稳定性相比,后者较强 |
下列说法正确的是
| A.蛋白质在空气中完全燃烧转化为水和二氧化碳 |
| B.汽油、甘油、花生油都属于酯类物质 |
| C.麦芽糖及其水解产物均能发生银镜反应 |
| D.燃煤产生的二氧化硫是引起雾霾的主要原因 |