下列实验操作不正确的是
| A.蒸发食盐水制取氯化钠晶体时,要等水完全蒸干后再停止加热 |
| B.用胶头滴管向试管中滴加液体时,不能伸入试管中滴加 |
| C.稀释浓硫酸时,将浓硫酸沿烧杯内壁慢慢地加入水中,用玻璃棒不断搅拌 |
| D.用托盘天平称量氢氧化钠固体时,可将氢氧化钠置于小烧杯中 |
硫酸铵在强热条件下分解:4(NH4)2SO4 =" 6" NH3↑+ N2↑+3SO2↑+SO3↑+7H2O若将生成的气体通入氯化钡溶液中,得到的沉淀物是
| A.BaSO3和BaSO4 | B.BaS | C.BaSO3 | D.BaSO4 |
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4FeO·Cr2O3 + 8Na2CO3 + 7O2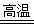 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
(2)2Na2CrO4 + H2SO4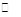 Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法正确的是
| A.反应(1)和(2)均为氧化还原反应 |
| B.反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3 |
| C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D.反应(1)中每生成1molNa2CrO4时电子转移3mol |
下列所作出的结论中一定正确的是
| A.无色试液使红色石蕊试纸变蓝,结论:该试液一定是碱溶液 |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO |
| C.无色试液焰色反应呈黄色,结论:试液中一定含有Na+ |
| D.无色试液加入碳酸钠溶液产生白色沉淀,结论:试液中含氢氧化钙 |
无色溶液可能由K2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成。向溶液中加入烧碱溶液出现白色沉淀,加入稀硫酸也出现白色沉淀并放出气体。据此分析,下列判断中正确的是
①肯定有BaCl2②肯定有MgCl2③肯定有NaHCO3
④肯定有K2CO3或NaHCO3⑤肯定没有MgCl2
| A.①②③ | B.②④ | C.①③ | D.①③⑤ |
下列各组物质中,W为主体物质,X为杂质,Y为除杂试剂,Z是除杂方法,其中正确选用了试剂和处理方法的是
| W |
X |
Y |
Z |
|
| A |
CH3COOC2H5 |
CH3COOH |
饱和Na2CO3溶液 |
分液 |
| B |
CO2 |
SO2 |
饱和Na2CO3溶液 |
洗气 |
| C |
NaCl固体 |
I2 |
CCl4 |
分液 |
| D |
Na2CO3 |
NaHCO3溶液 |
Ca(OH)2溶液 |
过滤 |