已知N2+3H2 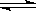 2NH3 △H<O ,反应速率为V1;2HI
2NH3 △H<O ,反应速率为V1;2HI 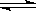 H2+I2 △H>O ,反应速率为V2。对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为
H2+I2 △H>O ,反应速率为V2。对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为
| A.同时增大 | B.同时减小 |
| C.V1增大,V2减小 | D.V1减小,V2增大 |
下列事实中,不能用勒夏特列原理解释的是
A.溴水中有下列平衡:Br2+H2O HBr+HBrO当加入AgNO3(s)后溶液颜色变浅 HBr+HBrO当加入AgNO3(s)后溶液颜色变浅 |
B.2NO2(g)  N2O4(g) (正反应放热),升高温度可使体系颜色加深 N2O4(g) (正反应放热),升高温度可使体系颜色加深 |
C.反应CO+NO2 CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 |
D.合成氨反应N2+3H2 2NH3(正反应放热)中使用催化剂 2NH3(正反应放热)中使用催化剂 |
CO(g)+H2O(g) H2(g)+CO2(g)ΔH﹤0,在其他条件不变的情况下
H2(g)+CO2(g)ΔH﹤0,在其他条件不变的情况下
| A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
| A.加热 | B.不用稀硫酸而用浓硫酸 |
| C.滴加少量CuSO4溶液 | D.不用铁片而用铁粉 |
下列措施肯定能使化学平衡移动的是
| A.增大反应物的量 | B.增加压强 |
| C.升高温度 | D.使用催化剂 |
在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2mol/L。下列说法正确的是
E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2mol/L。下列说法正确的是
| A.4min时,M的转化率为80% |
| B.4min时,用M表示的化学反应速率为0.8mol/(L·min) |
| C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小 |
| D.4min时,E的物质的量浓度为1.6mol/L |