(1)下列物质: ①Na ②Br2 ③Na2O ④NH3 ⑤CO2 ⑥蔗糖 ⑦NaCl晶体 ⑧KCl溶液 ⑨H2SO4 ⑩Ba(OH)2 ,其中属于电解质的是 ,属于非电解质的是 。 (用序号填写)
(2)从Ba(OH)2 、HCl 、Zn 、CuSO4、CaCO3中选出合适的物质,实现下列各题要求的变化,写出化学反应的离子方程式。
①实验室制取CO2的反应 。
②实验室制取H2的反应 。
③生成沉淀的反应 。
下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
① |
② |
|||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④和⑦的元素符号是和;
(2)表中8种元素中,金属性最强的元素的元素符号是,非金属性最强的元素的元素符号是。
(3)表中能形成两性氢氧化物的元素名称是,写出该元素的氢氧化物与③的最高价氧化物对应水化物反应的离子反应方程式:。
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。

(1)图中属于烷烃的是(填编号)。
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成和;不仅可以形成碳链,还可以形成碳环。
(3)上图中,B与互为同分异构体(填编号)。
(6分)下图表示Zn投入一定浓度一定体积的稀H2SO4溶液中后,反应时间与生成H2的体积的图象。(纵坐标为H2的生成速率)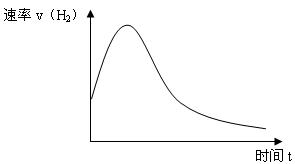
(1)反应前期速率加快的原因是:。
(2)反应后期速率下降的原因是:。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是:。
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 |
(1)冶炼金属常用以下几种方法:①还原法,②电解法,③热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)
Ⅰ.Fe、Zn、Cu 等中等活泼金属。
等中等活泼金属。
Ⅱ.Na 、Mg、Al等活泼或较活泼金属。
、Mg、Al等活泼或较活泼金属。
Ⅲ.Hg、Ag等不活泼金属。
(2)写出以锌片、铜片为两极,稀硫酸溶液为电解质溶液组成的原电池的电极反应式:
负极:;正极:。
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应,又能和烧碱反应;⑥F与C同主族。用化学符号回答下列问题:
(1)用电子式表示下列物质A2C2,DCA_________________;
(2)写出E与烧碱反应的离子方程式。
(3)写出DCA与B的最高价氧化物反应的化学方程式:
。