设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.0.1 mol NaOH中含有的阴离子数目为0.1NA |
| B.1 L 0. 05 mol/LCH3 COOH溶液中含有的H+数目为0.05NA |
| C.标准状况下,44.8 LCCl4含有的分子数为2NA |
| D.反应:ClO3-+5Cl- +6H+=3Cl2+3H2O中,每生成1 mol Cl2,转移的电子数为2NA |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
② CH3OH(g)+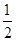 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
则下列说法正确的是( )
| A.CH3OH的燃烧热为192.9 kJ/mol |
B.反应①中的能量变化如图所示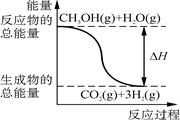 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应:CH3OH(l)+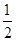 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol |
下列有关溶液中粒子浓度的关系式中,正确的是( )
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列
有关说法正确的是( )
| A.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| B.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| C.因为H2SO4是强酸,所以反应:CuSO4十H2S=CuS↓+H2SO4不能发生 |
| D.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L |
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe。有关该电池的下列叙述中,正确的是( )
| A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| B.该电池的电池反应式为2Li+FeS=Li2S+Fe |
| C.负极的电极反应式为Al-3e-=Al3+ |
| D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-=2Li++FeS |
在一定条件下,向一体积为2 L的恒容密闭容器中充入2 mol A,1 mol B,发生反应:2A(g)+B 3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
| A.用C的浓度变化表示该反应速率为2.4 mol/(L·min) |
| B.若使容器变为1 L,则C的物质的量一定增大 |
| C.达到平衡,测得放出热量为x kJ,则x=Q |
| D.若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态 |