R2O8n-离子在一定条件下可把Mn2+氧化为MnO4-,若反应后R2O8n-离子变RO42-离子, 又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值是
| A.4 | B.3 | C.2 | D.1 |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.电解精炼铜时,阳极质量每减少32g,阴极上生成Cu原子数约为0.5×6.02×1023 |
| B.标准状况下,22.4LNO和11.2L氧气混合,原子总数 为3NA个,分子总数约为1.5NA个, |
| C.28 g N60单质(见图)中含有的N—N键键数为3NA |
| D.1molNa2CO3晶体中含有阴离子数为NA 个 |

某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是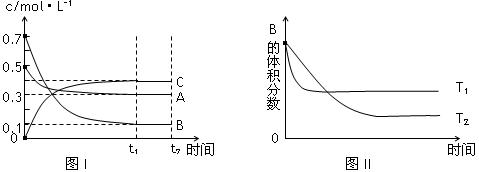
A.该反应的热化学方程式为:A(g )+3B(g) 2C(g) ;△H>0
2C(g) ;△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
X、Y、Z和W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y、 W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17。则下列有关叙述正确的是
| A.Y、Z和W三种元素不可能位于同一周期 |
| B.上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高 |
| C.Y和W所形成的含氧酸均为强酸 |
| D.X、Y、Z和W可形成X5YZ4W的离子化合物 |
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系,下列说法正确的是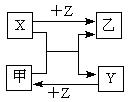
| A.X、Y、Z一定是非金属单质 |
| B.X、Y、Z中至少有一种是金属单质 |
| C.若X、Y都为金属单质,则Z必为非金属单质 |
| D.若甲为FeI2,则乙可能为FeCl2 |
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是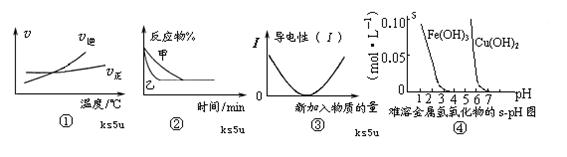
A.根据图①可判断可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH>0 2AB3(g)”的ΔH>0 |
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右 |