(1)已知:① 2H2(g)+O2(g)=2H2O(l) △H1=" -a" kJ•mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 =" -b" kJ•mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 =" -c" kJ•mol-1
CH3OH(g) △H3 =" -c" kJ•mol-1
计算甲醇蒸气的标准燃烧热H=
(2)①As2S3和HNO3反应如下:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在 (填“正极”或“负极”)附近逸出,该极的电极反应式为 。
②利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”)。

③利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

Co(OH)3溶解还原反应的离子方程式为 。
向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
I.CH4(g)+2O2(g)  CO2(g)+2H2O(g) ΔH1=一802.6 kJ/mol
CO2(g)+2H2O(g) ΔH1=一802.6 kJ/mol
II. CH4(g)+O2(g)  CO2(g)+2H2 (g) ΔH2=一322.O kJ/mol
CO2(g)+2H2 (g) ΔH2=一322.O kJ/mol
III. CH4(g)+ H2O(g)  CO(g)+3H2 (g) ΔH3=+206.2 kJ/mol
CO(g)+3H2 (g) ΔH3=+206.2 kJ/mol
IV. CH4(g)+ 2H2O(g)  CO2 (g)+4H2 (g) ΔH4=+165.O kJ/mol
CO2 (g)+4H2 (g) ΔH4=+165.O kJ/mol
请回答下列问题:
(1)CH4的燃烧热ΔHΔH1(填“>”“<”或“=”)。
(2)在反应初始阶段,反应Ⅱ的反应速率大于反应Ⅲ的反应速率。比较反应Ⅱ的活化能EⅡ和反应Ⅲ的活化能EⅢ的大小.EⅡEⅢ(填“>”、“<”或“=”)。
(3)在1 L固定容积密闭容器中投入1.8 mol CH4和3.6 mol H2O(g),若只发生反应Ⅳ,测得CH4、H2O(g)及某一生成物的物质的量浓度(c)随反应时间(t)的变化如图所示[第9 min前H2O(g)的物质的量浓度及第4 min~9 min之间X所代表生成物的物质的量浓度变化曲线未标出,条件有变化时只考虑改变一个条件)。
①O~4 min内,H2的平均反应速率V(H2)= mol·(L·min)-1;
②反应在5 min时的平衡常数K=;
③第6 min时改变的条件是;判断理由是;
④比较第5 min时的平衡常数K(5 min)与第10 min时平衡常数K(10 min)的大小:K(5 min)K(10 min) (填“>”、“=”或“<”),原因是。
碱式碳酸钴[Cox(OH)y(C03)z]常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置进行实验。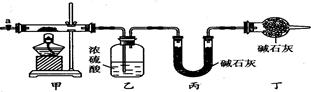
(1)请完成下列实验步骤:
①称取3.65 g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并.
③加热甲中玻璃管,当乙装置中(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是o
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的(填字母)连接在(填装置连接位置)。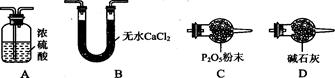
(4)若按正确装置进行实验,测得如下数据。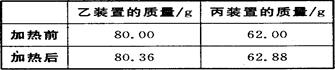
则该碱式碳酸钴的化学式为。
(5)含有Co(A102)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为。
(6)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下: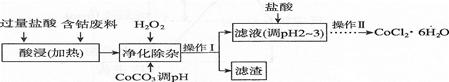
已知:25℃时,Ksp[Fe(OH)3]=2.79X10-39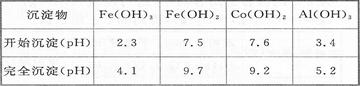
①净化除杂时,加入H2O2发生反应的离子方程式为
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为 。
③已知:Fe(OH)3(s)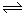 Fe3+(aq)+3OH-(aq)ΔH=akJ/mol
Fe3+(aq)+3OH-(aq)ΔH=akJ/mol
H2O(l)=H+(aq)+OH-(aq)ΔH="b" kJ/mol
请写出Fe3+发生水解反应的热化学方程式:.
水解平衡常数Kh=.
④加盐酸调整pH为2~3的目的为。
⑤操作Ⅱ过程为蒸发浓缩、(填操作名称)、过滤。
(7)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料C6中(如图所示)。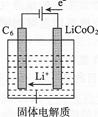
电池反应为LiCoO2+C6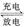 CoO2+LiC6,写出该电池放电时的正极反应式:。
CoO2+LiC6,写出该电池放电时的正极反应式:。
(14分)普通钢中加入少量的钒(V))能极大地改善钢的弹性和强度,使钢材既耐高温又抗奇寒,因此它有“合金维生素”之称。'T业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2) 中钒的主要流程如下:
回答下列问题:
(1)滤渣l的主要成分是。
(2)步骤②中发生反应的离子方程式为。
(3)步骤③的变化过程可简化为(HA表示有机萃取剂):VOSO4 (水层)十2HAc(有机层) VOA2(有机层) 十H2SO4 (水层),则步骤④中可选择硫酸作萃取剂的原因是。萃取和反萃取在实验室里用到的玻璃仪器有和。
VOA2(有机层) 十H2SO4 (水层),则步骤④中可选择硫酸作萃取剂的原因是。萃取和反萃取在实验室里用到的玻璃仪器有和。
(4)该工艺流程中,可以循环利用的物质除了氨气以外,还有 。
(5)调节溶液pH,可将(VO2)SO4转变成NH4VO3沉淀。25℃时,当pH 为1. 7~1. 8 时,钒沉淀率为98. 8%,假设其它各步反应都完全进行,已知KC1O3的还原产物是KCl,若每消耗1 mol KC1O3,理论上可回收金属钒g(计算结果保留一位小数)。
(16分)聚乙酸乙烯酪广泛用于制备涂料、粘合剂等,它和高聚物长的合成路线如下: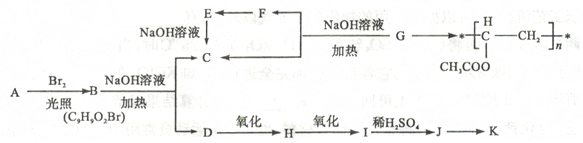
其中J物质与氯化铁溶液能发生显色反应,且苯环上的一元取代物原有两种。
已知①当羟基与双键碳原子相连时,易发生如下转化RCH =CHOH→RCH2CHO
②一ONa连在烃基生不会被氧化
请回答下列问题:CH3COO CH3CH2Br
(1)写出G的结构简式。F与H中具有相同官能团的名称。
(2)上述变化中G→C+F 的反应类型是;J在一定条件下能生成高聚物K,K的结构简式是。
(3)写出B→C+D反应的化学方程式:。
(4)同时符合下列要求的A的同分异构体有种。
I含有苯环
II能发生银镜反应和水解反应
并写出满足下列条件的同分异构体结构简式:。
①核磁共振氢谱有5 个吸收峰
②1mol该同分异构体能与Imol NaOH 反应
(5)下列有关说法正确的是。
a.1 mol A 完全燃烧消耗10.5 mol O2
b.J与足量的碳酸氢钠溶液反应能生成相应的二钠盐
c.D→H 的试剂通常是KMO4酸性溶液
d.J能发生加成、消去、取代、氧化等反应
(14分)X、Y、及W是短周期中的四种元素,其原子序数依次增大。相关信息如下表
| 元素 |
相关信息 |
| X |
具有多种同素异形体,形成的化合物种类繁多 |
| Y |
短周期主族元素中原子半径最大 |
| Z |
位于元素周期表金属与非金属元素的分界线上,最高化合价为十4 |
| W |
富集在海水中的元素,它的某些化合物常用作消毒刹 |
(1)Z元素基态原子的核外电子排布式为,其未成对的电子数目为。
(2)Y位于元素周期表中第周期,第族,四种元素的电负性由大到水的顺序是(写元素符号)。
(3)氢化物中X-H和W-H的化学键极性较强的是,耐磨材料(XY)和单质y 熔点较高的
是(均用元素符号表示)。
(4)已知400 ℃时,HW 可被氧气催化氧化生成W 的单质,从而实现化更生产上W的循环利用。若断开1mo1H一W化学键,该反应放热28.9KJ,试写出相应的热化学方程式:。