碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种无毒、用途广泛的化工原料,被誉为当今有机合成的“新基石”。
(1)浙江大学用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC的研究开发。
已知:ⅰ CO的标准燃烧热:-283.0 kJ•mol-1,
ⅱ 1mol H2O(l)完全蒸发变成H2O(g)需吸收44 kJ的热量
ⅲ 2CH3OH(g)+CO2 (g)  CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJ•mol-1
CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJ•mol-1
则2CH3OH(g)+CO(g)+ 1/2O2(g)  CH3OCOOCH3 (g)+H2O(l) △H= 。该反应在常压和70~120℃条件下就能自发反应的原因是 。
CH3OCOOCH3 (g)+H2O(l) △H= 。该反应在常压和70~120℃条件下就能自发反应的原因是 。
(2)甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)  CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
① 写出该反应平衡常数表达式: 。
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是 (选填编号)。
A.v正(CH3OH)= 2v逆(CO2)
B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变
D.容器内压强不变
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5 molCH3OH(g)、适量CO2和6×10-5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如下左图所示。计算公式为:TON = 转化的甲醇的物质的量/催化剂的物质的量。

在该温度下,最佳反应时间是 ;4~10 h内DMC的平均反应速率是_ ___。
④如果在其它条件不变的情况下,研究反应温度对甲醇转化数(TON)的影响,请在右上图坐标系中画出从投入反应物开始,随着反应温度不断升高(不考虑温度对催化剂活性的影响),TON变化的曲线示意图(假设起始温度为T0℃)。
⑤假设在密闭容器中发生上述反应,达到平衡时下列措施能提高TON值的是 。
A.往反应体系中添加催化剂
B.往反应体系中添加吸水剂
C.从反应体系中分离出CO2
D.扩大容器的体积
 钛(Ti )被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
钛(Ti )被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白: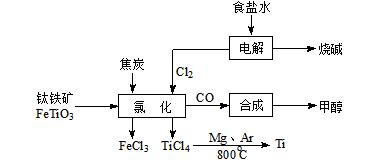

 (l)电解饱和食盐水时,总反应的离子方程式是。
(l)电解饱和食盐水时,总反应的离子方程式是。 (2)写出钛铁矿经氯化法得到四氯化钛的化学方程。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程。 (3)已知:①Mg(s) + Cl2(g)=MgCl2(s)△H =-641kJ·mol-1
(3)已知:①Mg(s) + Cl2(g)=MgCl2(s)△H =-641kJ·mol-1 ②Ti(s) + 2Cl2(g)=TiCl4(s)△H = -770kJ·mol-1
②Ti(s) + 2Cl2(g)=TiCl4(s)△H = -770kJ·mol-1 则2Mg(s) + TiCl4(s)=2MgCl2(s) + Ti(s)△H=。
则2Mg(s) + TiCl4(s)=2MgCl2(s) + Ti(s)△H=。 反应2Mg(s) + TiCl4(s)
反应2Mg(s) + TiCl4(s)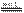 2MgCl2(s) + Ti,在Ar气氛中进行的理由是: ______________________________________。
2MgCl2(s) + Ti,在Ar气氛中进行的理由是: ______________________________________。
 (4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是。
下面是以化合物Ⅰ为原料合成一种香精(化合物Ⅵ)的合成路线,反应在一定条件下进行。化合物Ⅵ广泛用于香精的调香剂。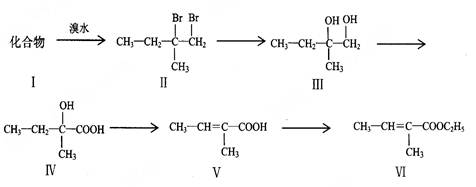
回答下列问题:
(1)化合物Ⅰ生成化合物Ⅱ的反应原子利用率可达100%,化合物Ⅰ的结构简式为
(2)写出化合物Ⅴ合成化合物Ⅵ的反应方程式
(3)写出一种可鉴别化合物Ⅲ和Ⅳ的化学试剂:
(4)化合物Ⅴ的多种同分异构体中,与化合物Ⅴ官能团种类相同且无支链的共
有种。
(5)化合物Ⅵ不能发生的反应类型是
| A.加成反应 | B.酯化反应 | C.水解反应 | D.加聚反应 |
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为2L的密闭容器中,充入1molCO2和3.25molH2,在一定条件下发生反应,测定CO2、CH3OH和H2O(g)的浓度随时间变化如图所示:
①写出该工业方法制取甲醇的化学方程式:。
②从反应开始到平衡,氢气的平均反应速率v(H2)=。
③反应到达平衡后,再向该容器中通入1 mol CO2和3.25 mol H2,重新到达平衡后,H2的转化率将(填增大、减小或不变)
④下列措施中一定能使n(CH3OH)/ n(CO2)增大的是:。
| A.向容器中充入一定量的氦气 | B.充入CO2 |
| C.将水蒸气从体系中分离 | D.用更有效的催化剂 |
(2)可燃性的有机物和氧气在理论上都可以作为燃料电池中的反应物,请写出CH3OH—O2—KOH燃料电池的负极的电极反应式:
(3)若将一定数量的C3H8—O2—KOH燃料电池按一定方式组成电池组以满足电解需要的电压。现用该电池组电解500mL某CuSO4的稀溶液(用铂为电极),电解后的溶液需要加入98克Cu(OH)2才能使溶液恢复到原硫酸铜溶液的浓度和质量。若忽略电池组在电解过程中的能量损失,其能量全部用来电解CuSO4溶液,则:
①原CuSO4溶液物质的量浓度
②该电池组消耗的丙烷在标准状况时的体积
下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
根据下图回答问题: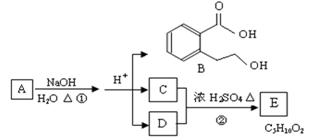
(1)C分子中的官能团名称是: ______________;下列反应中,化合物B不能发生的反应是(填字母序号):
a 加成反应 b取代反应 c消去反应 d酯化反应 e水解反应 f加聚反应。
(2)反应②的化学方程式是 ________。
(3)A的结构简式是 __________________。
(4)同时符合下列三个条件的B的同分异构体的数目有个。
Ⅰ.含有间二取代苯环结构Ⅱ.属于非芳香酸酯Ⅲ.与 FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式
(5)常温下,将C溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液pH如下表:
| 实验编号 |
C物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| m |
0.1 |
0.1 |
pH=9 |
| n |
0.2 |
0.1 |
pH<7 |
从m组情况分析,用离子方程式表示该溶液pH=9的原因。
n组混合溶液中离子浓度由大到小的顺序是。
(13分) A~L均为化学实验室中常见的物质,它们有以下转化关系。其中:I是一种黄绿色有毒气体,B、D、E、G均为家庭中常见的物质,常温下,B为无色液体,L是一种具有水果香味的液体。试回答下列问题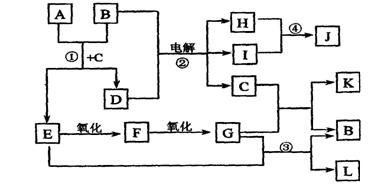
(1)A的名称: C的电子式:
(2)写出反应①的化学反应方程式
写出反应②的离子方程式
(3)实验室以E为原料制取一种植物生长调节剂的化学方程式为: .