某溶液中含有1.2×10-3 mol XO3-,恰好能氧化30mL 0.1mol/LNa2SO3溶液(形成Na2SO4溶液),则还原产物中元素X的化合价是
| A.0 | B.- 2 | C.+3 | D.+2 |
下列叙述不正确的是
| A.根据金属活动性顺序表,可以推断冶炼金属时可能的方法 |
| B.CaCl2、MgCl2晶体都容易潮解,它们潮解的实质是晶体表面吸水形成溶液 |
| C.根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量 |
| D.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行 |
下表中列出了25℃、101kPa时一些物质的燃烧热数据
| 物质 |
CH4 |
C2H2 |
H2 |
| 燃烧热/kJ/mol |
890.3 |
1299.6 |
285.8 |
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。则下列叙述正确的是
A.2H2(g)+O2(g)=2H2O(g)△H=﹣571.6 kJ/mol
B.C—H键键长小于H—H键
C.C≡C键能为796.0 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
2A(g) B(g)+C(g);ΔH =-48.25 kJ·mol-1
B(g)+C(g);ΔH =-48.25 kJ·mol-1
反应过程中B、A的浓度比与时间t有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,下列结论正确的是
A.该温度下此反应的平衡常数为3.2B.A的初始物质的量为4 mol
C.反应到达平衡时,放出的热量是193kJD.反应达平衡时,A的转化率为80%
下列排序正确的是
| A.热稳定性:H2O>H2S>HF | B.酸性:NaHSO4>CH3COOH>H2CO3 |
| C.碱性:Ba(OH)2>Ca(OH)2>KOH | D.沸点:CH4>NH3>H2O |
用下列实验装置进行相应实验,能达到实验目的的是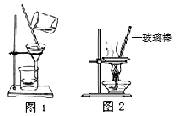


| A.用图1 所示装置除去Fe(OH)3胶体中含有的少量FeCl3杂质 |
| B.用图2 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3 所示装置从海水制取蒸馏水 |
| D.用图4 所示装置分离酒精萃取碘水中的碘 |