对于可逆反应A(g)+2B(g)  C(g) ΔH<0,下列“研究目的”和“图示”相符的是
C(g) ΔH<0,下列“研究目的”和“图示”相符的是
| 选项 |
A |
B |
C |
D |
| 研究 目的 |
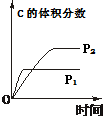
压强对反应的 影响(P2>P1) |
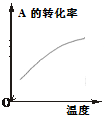
温度对反应的影响 |
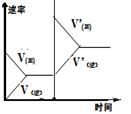
平衡体系增加A 对反应的影响 |
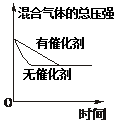
催化剂对反应的影响 |
| 图示 |
 |
 |
 |
 |
下列除杂的操作方法正确的是()
| A.NO中有少量的NO2:用水洗涤后再干燥 |
| B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 |
| C.Cl2中有少量的HCl:通过氢氧化钠溶液洗气 |
| D.CO2中混有少量的SO2气体:通过饱和NaHSO3溶液洗气 |
下列有关无机非金属材料的说法中,不正确的是()
| A.高纯硅可用于制造半导体材料 |
| B.SiO2制成的玻璃纤维,由于导电能力强而被用于制造光缆 |
| C.玻璃、水泥和陶瓷,其成分均含有硅酸盐 |
| D.Si3N4是一种新型无机非金属材料,可应用于制造发动机 |
据报道,某些建筑材料会产生放射性同位素氡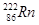 ,从而对人体产生伤害,该同位素原子的中子数和质子数之差是 ( )
,从而对人体产生伤害,该同位素原子的中子数和质子数之差是 ( )
| A.136 | B.50 | C.86 | D.222 |
下列叙述正确的是()
| A. | 将 通入 溶液中至饱和,无沉淀产生;再通入 ,产生沉淀 |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入 固体,铜粉仍不溶解 |
| C. | 向 溶液中滴加氨水,产生白色沉淀;再加入 溶液,沉淀消失 |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量 固体,速率不改变 |
下列物质中,含有极性共价键的是()
| A.单质碘 | B.氯化镁 | C.溴化钾 | D.水 |