某探究性学习小组设计如右图所示装置分别进行如下探究实验,请回答下列问题:
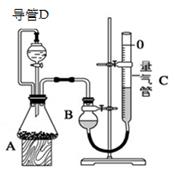
| 实验 |
药品 |
制取气体 |
量气管中的液体 |
| Ⅰ |
Cu、稀HNO3 |
|
H2O |
| Ⅱ |
NaOH固体、浓氨水 |
NH3 |
|
| Ⅲ |
镁铝合金、足量NaOH溶液 |
H2 |
H2O |
(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是 ;
(2)实验Ⅱ中量气管中的液体最好是 (填字母编号, 下同)
A.NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
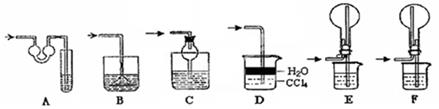
实验剩余的NH3需吸收处理,以下各种尾气吸收装置中,不能防止倒吸的是 ;
(3)①写出实验Ⅲ中涉及的离子反应方程式 ;
②反应前,先对量气管进行第一次读数。读数时,应注意的操作是 ,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数。实验前,如拆去导管D,测得的气体体积将 (填“偏大”、“偏小”、或“无影响”)。
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
| 编号 |
镁铝合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| ① |
1.0g |
10.0mL |
376.6mL |
| ② |
1.0g |
10.0mL |
364.7mL |
| ③ |
1.0g |
10.0mL |
377.0mL |
根据上述数据,计算出镁铝合金中铝的质量分数为 。
(12分)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3.5mol/(L・min);乙v(Y)=2mol/(L・min);丙v(Z)=4.5mol/(L・min);丁v(X)=0.075mol/(L・s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) 。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向 (填"左"或"右"或"不")移动;若向
达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不")移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的
平衡中的X的转化率相比较。
| A.无法确定 | B.⑷一定大于⑴ | C.⑷一定等于⑴ | D.⑷一定小于⑴ |
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,则a、b、c应该满足的关系为 。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 。
煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH是最重要的研究方向之一。在2L的密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。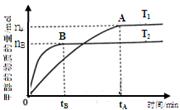
①通过分析上图,可以得出对反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的说法正确的是(填
CH3OH(g)+H2O(g)的说法正确的是(填
序号)。
| A.该反应为放热反应 |
| B.T1时的反应速率大于T2时的反应速率 |
| C.该反应在T1时的平衡常数比T2时的大 |
| D.处于A点的反应体系从T1变到T2,达平衡时n(H2)/n(CH3OH)增大 |
②下列情形能说明上述反应已达到平衡状态的是(填序号)
a.体系压强保持不变 b.v(H2)=3v(CO2)
c.CH3OH与H2物质的量之比为1:3 d.每消耗1 mol CO2的同时生成3molH2
e.密闭容器中混合气体的密度不变 f.密闭容器中CH3OH的体积分数不变
③在T1温度时,将2molCO2和6molH2充入该密闭容器中,充分反应达平衡时,若CO2的转化率为60%,则容器内的压强与起始压强之比为,该反应的平衡常数为。
(1)在密闭容器中进行下列反应:M(g) + N(g) R(g) + 2L(?),此反应规律符合下图图像。
R(g) + 2L(?),此反应规律符合下图图像。
①T1T2,正反应的△H0。(填“>”、“<”或“=”,下同)。
②P1P2 , L为。(填“固”或“液”或“气”态)。
(2)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g) H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是(填“增大”、“减小”或“不变”)。②若在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量92.4kJ.(填“>”、“<”或“=”)。
③将1 mol N2和3 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,此时欲提高该容器中H2的转化率,下列措施可行的是(填字母)。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率分别为mol、。
(1)已知红磷比白磷稳定,又知:4P(白磷,s)+5O2(g)=2P2O5(s) △H1;
4P(红磷,s)+5O2(g)=2P2O5(s) △H2,则ΔH1和ΔH2的关系是△H1△H2(填“>”、“<”
或“=”)。
(2)已知H2(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1和-726.5kJ·mol-1,写出由CO2
和H2生成液态甲醇和液态水的热化学方程式。
(3)已知一定温度下,下列反应的平衡常数:SO2(g)+1/2O2(g)  SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g)  CO2(g) K2。则相同温度下反应SO2(g)+CO2(g)
CO2(g) K2。则相同温度下反应SO2(g)+CO2(g)  SO3(g)+CO(g)的平衡常数为。
SO3(g)+CO(g)的平衡常数为。
(用K1、K2表示)
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为,所得溶液中的溶质物质的量浓度为mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为mL,所得溶液溶质物质的量浓度为 mol·L-1。