结合下表回答下列问题(均为25℃时的数据)
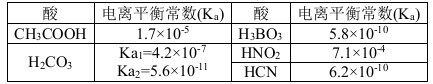
(1)上述五种酸中,酸性最强的是 (填化学式)。HCO3-的电离平衡常数表达式K= 。
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:H3BO3+ OH-= B(OH)4-, 则硼酸为 元酸,硼酸的电离方程式为 。
(3)常温下,0.01 mol·L-1的HNO2溶液加水稀释的过程中,下列各项数据增大的是 (填代号)。
①c(H+ ) ②c (NO2- )/ c(H+) ③Ka(HNO2)
④c(H+ )/ c(HNO2) ⑤c(OH -) ⑥
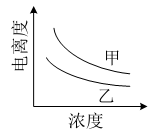
(4)右图描述的是醋酸与HNO2在水中的电离度与浓度关系,其中反映醋酸的是曲线 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数) 。
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是 (填代号)。
| A.H2CO3、HCO3-、 CH3COO-、CN- | B.HCO3-、 CH3COOH、CN-、CO32— |
| C.HCN、 HCO3-、CN-、CO32— | D.HCN、 HCO3-、CH3COO-、CN- |
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作)。
A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
| 元素 |
有关性质或结构信息 |
| A |
负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B |
B原子得到一个电子后3p轨道全充满 |
| C |
C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D |
D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E |
E元素的核电荷数等于A元素和B元素氢化物的核电荷数之和 |
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B) I1(Y)。
(2)E元素原子的核外电子排布式为
(3)盐X的水溶液呈 (填“酸性”、“碱性”或“中性”),B元素最高价含氧酸一定比D元素最高价含氧酸的酸性 (填“强”或“弱”)。
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: ,
写出该阳离子与硫的氢化物的水溶液反应的离子方程式:
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。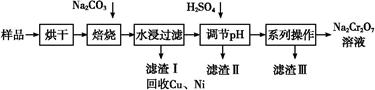
已知:在Na2CrO4溶液中含有少量NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈 性(填“酸”、“碱”或“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式。
Cr(OH)3+ Na2CO3+ 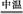 Na2CrO4+ CO2+
Na2CrO4+ CO2+
(3)滤渣Ⅱ的主要成分有Zn(OH)2、 。
(4)“系列操作”中为:继续加入H2SO4, ,冷却结晶,过滤。继续加入H2SO4目的是 。
已知:①除去滤渣II后,溶液中存在如下反应:
2CrO42—+2H+ Cr2O72—+H2O
Cr2O72—+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 溶解度 化学式 |
20 ℃ |
60 ℃ |
100 ℃ |
| Na2SO4 |
19.5 |
45.3 |
42.5 |
| Na2Cr2O7 |
183 |
269 |
415 |
| Na2CrO4 |
84 |
115 |
126 |
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨作电极电解生产金属铬,写出生成铬的电极反应方程式 。
材料是人类生存和发展的重要物质基础,随着科学技术的发展,人们使用材料的种类、数量和质量也不断的发展,生产、生活的条件和质量也发生了巨大的变化。
(1)无机非金属材料包括传统无机非金属材料和无机非金属新材料,下列属于无机非金属新材料的是 (多选,选填字母代号)。
a.复合材料 b.单晶硅 c.金刚石 d.石墨e.C60 f.玻璃
(2)北京奥运会撑杆跳项目中运动员使用的撑杆材料是复合材料。这种材料由 和增强体两部分组成,其中增强体的作用是 。
(3)玻璃和水泥是两种用途极为广泛的材料。工业制备这两种材料使用的共同原料是 。
(4)铁是重要的金属材料,工业上一般用石灰石、 、 和空气在 (填写工业生产设备名称)中炼制生铁。
(5)合成高分子材料的小分子叫 。
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下:
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO):;
(2)写出ZrOCl2·8H2O在900 ℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选)。
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1纳米=10-10米 |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起 |
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图
(1)上述生产纯碱的方法称 ,副产品的一种用途为 。
(2)沉淀池中发生的化学反应方程式是 。
(3)写出上述流程中X物质的分子式 。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度